
| A.浓硫酸、浓盐酸暴露在空气中浓度降低 |
| B.氯水、活性炭使红墨水褪色 |
| C.苯、四氯化碳加入溴水中,振荡、静置,水层颜色变浅 |
| D.漂白粉、亚硫酸钠长期暴露在空气中变质 |
科目:高中化学 来源:不详 题型:单选题
| A.加入有色布条,一会儿有色布条褪色,证明有Cl2存在 |
| B.溶液呈黄绿色,且有刺激性气味,证明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液,产生白色沉淀,证明有Cl-存在 |
| D.加入NaOH溶液,氯水黄绿色消失,证明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
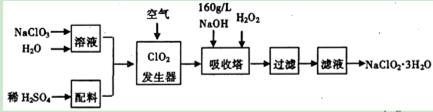
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
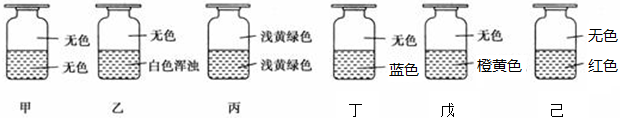
| A.④①②⑥⑤③ | B.⑥①③④②⑤ | C.⑥③②④①⑤ | D.②①③④⑥⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
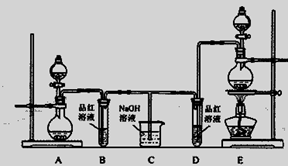
 MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
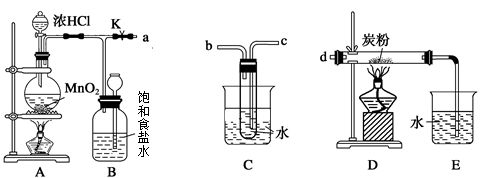
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可能是单一气体 | B.不可能含有一氧化碳 |
| C.可能存在原气体中的两种气体 | D.成分和洗气瓶的排列顺序无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气有毒,可以毒死细菌、病毒 |
| B.氯气具有刺激性气味,可以熏死细菌、病毒 |
| C.氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 |
| D.氯气用于自来水消毒的工艺简单、成熟,易于操作,且成本低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com