
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________
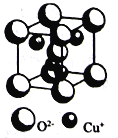
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
【答案】3d104s2 1 正四面体 配位键和极性共价键 sp3 大 NH3分子和H2O分子均为极性分子,且NH3分子和H2O分子之间能形成氢键 铜失去的是全充满的3d10电子,而锌失去的是半充满的4s1电子,4s能级的能量低于3d能级的能量 4 ![]()
【解析】
(1)基态锌原子的核外电子排布式为:[Ar]3d104s2,故其价电子排布式为3d104s2;基态铜元素的核外电子排布式为:[Ar]3d104s1,其4s能级轨道中有1个未成对电子;
(2)①[Zn(NH3)4]SO4中,阴离子为SO42-,中心原子S的孤电子对数=![]() (6+2-4×2)=0,SO42-离子的价层电子对数为4,故其空间立体构型为正四面体;[Zn(NH3)4]2+为配位离子,N与H之间的化学键是极性共价键,N与Zn2+之间是配位键,故[Zn(NH3)4]2+中含有的化学键有极性共价键和配位键;
(6+2-4×2)=0,SO42-离子的价层电子对数为4,故其空间立体构型为正四面体;[Zn(NH3)4]2+为配位离子,N与H之间的化学键是极性共价键,N与Zn2+之间是配位键,故[Zn(NH3)4]2+中含有的化学键有极性共价键和配位键;
②NH3分子中成键电子对数为3,孤电子对数为1,故中心原子的轨道杂化类型为sp3;NH3在水中的溶解度极大(1:700);其原因是:NH3分子和H2O分子均为极性分子,且NH3分子和H2O分子之间能形成氢键;
(3)Cu的第二电离能大于Zn的第二电离能的原因是:铜失去的是全充满的3d10电子,而锌失去的是半充满的4s1电子,4s能级的能量低于3d能级的能量,因此Cu的第二电离能大于Zn的第二电离能;
(4)由晶胞图可知,O2-位于四个Cu+形成的正四面体的体心内,故O2-的配位数为4。由均摊法可知,一个晶胞中含有8×1/8+1=2个O2-和4个Cu+,即一个晶胞中含有两个Cu2O,一个晶胞的质量为![]() ,由此可知晶胞参数a=
,由此可知晶胞参数a= cm=
cm=![]() 。
。


科目:高中化学 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。
回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)AsCl3分子中砷的杂化类型是___________;AsO43-的空间构型是___________。
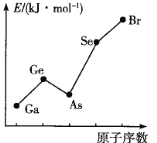
(3)电子亲和能是反映元素性质的参数之一,电子亲和能指基态气态原子得1个电子形成负一价阴离子时释放的能量(kJ·mol-1),第四周期主族元素Ga、Ge、As、Se、Br的电子亲和能大小变化如图所示。砷的电子亲和能“突变”的主要原因是_________________________________。
(4)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。配位原子提供孤电子对的能力与元素的电负性大小有关,电负性越大,其原子不容易提供孤电子对,则Fe(CO)5中提供孤电子对的原子是__ (填元素符号);与CO互为等电子体的分子是___________。
(5)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是___________。
(6)氧化镍晶胞如图1所示,单原子层氧化镍的结构如图2所示。
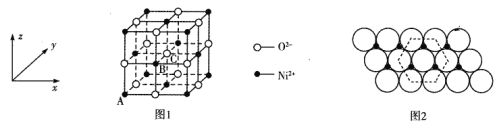
①图1中,原子坐标参数:A(0,0,0)、B(![]() ,0,
,0,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
②图2中,已知氧离子半径为apm(忽略镍离子半径),NA是阿伏加德罗常数的值。每平方米含氧化镍的质量为___________g。(提示:将图2中氧离子切割成正六边形作最小基元)
查看答案和解析>>
科目:高中化学 来源: 题型:
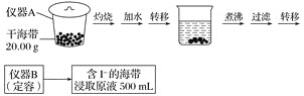
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
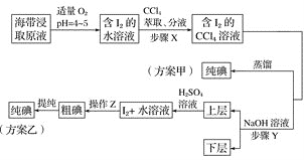
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) ![]() N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,0.5mol N2和1mol O2 的混合气体的体积约是_____.
(2)标准状况下,气体的摩尔体积是______,0.5mol CO2 的质量是____,在标准状况下的体积是_____.
(3)①标准状况下,2mol NH3与 _______g CO2的体积相等.
②等质量的O2和O3所含的原子个数之比是______.
③用金属Na、Mg、Al与足量的稀盐酸反应,欲制取相同条件下等体积的H2,则需要金属Na、Mg、Al的质量比为_____(最简整数比).
④已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的相对分子质量为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度(分子电离的百分数)为______________,加入0~10 mL的氨水导电能力增强的原因_________________________。
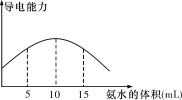
(2)将醋酸铵固体溶于水,配成0.1 mol·L-1溶液,已知醋酸的电离平衡常数为Ka,一水合氨的电离平衡常数为Kb,实验发现两者近似相等,请写出醋酸铵水解的离子方程式______________________,水解平衡常数的表达式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42— |
B | 先滴加足量稀硝酸,再滴入AgNO3溶液 | 开始无明显现象,后产生白色沉淀 | 原溶液中有Cl- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。
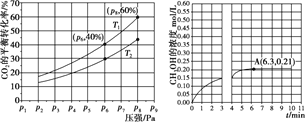
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com