
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
分析 ①Na先和水反应,然后NaOH再和氯化铁发生复分解反应;
②过量Ba(OH)2溶液和明矾溶液混合,二者反应生成硫酸钡白色沉淀;
③碳酸氢钡和硫酸氢钠发生复分解反应;
④过氧化钠先和水反应生成氢氧化钠,然后NaOH再和氯化铁反应发生复分解反应.
解答 解:①Na先和水反应生成氢氧化钠和氢气,然后NaOH再和氯化铁发生复分解反应生成氢氧化铁沉淀,所以有气体和沉淀生成,故正确;
②过量Ba(OH)2溶液和明矾溶液混合,二者反应生成硫酸钡白色沉淀,离子方程式为Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,最终有白色硫酸钡沉淀,故错误;
③碳酸氢钡和硫酸氢钠发生复分解反应,反应方程式为:Ba(HCO3)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4+2CO2↑,所以符合题意,故正确;
④过氧化钠先和水反应生成氢氧化钠,然后NaOH再和氯化铁反应发生复分解反应,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑、3NaOH+FeCl3=Fe(OH)3↓+3NaCl,所以符合题意,故正确;
故选C.
点评 本题考查了物质间的反应,明确物质的性质是解本题关键,根据物质的性质来分析解答,熟练掌握元素化合物之间的反应,如果将④中FeCl3换为FeCl2,因为过氧化钠具有强氧化性,所以仍然得到Fe(OH)3,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:解答题
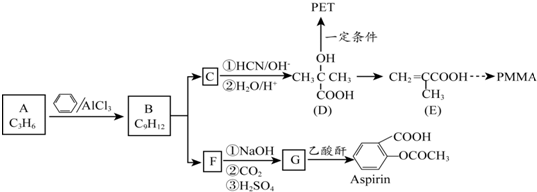
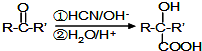
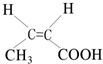 .
. .
.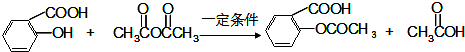 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保护环境、保护地球已成为人类共同的呼声.
保护环境、保护地球已成为人类共同的呼声.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过Na2O2固体 | B. | 镁粉投入FeCl3溶液中 | ||
| C. | 铝粉与Fe2O3发生铝热反应 | D. | 焦炭在电炉中还原二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 | |
| B. | 施肥时,草木灰(有效成分为 K2CO3)不能与碳酸氢铵混合使用 | |
| C. | Al2S不能用复分解反应的方法在溶液中制取,而只能用干法制备 | |
| D. | 配制 FeCl2溶液时常常要在溶液中加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
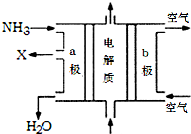 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②④⑤ | C. | ①②③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com