
| A. | 减小容器体积,平衡向右移动 | |
| B. | 加入催化剂,平衡不移动故正逆反应速率不变 | |
| C. | 增大c(X),X的转化率增大 | |
| D. | 降低温度,Y的转化率增大 |
分析 A.减小容器体积,压强增大,该反应为气体体积不变的反应;
B.催化剂同等程度改变反应速率;
C.增大c(X),促进Y的转化;
D.△H<0,为放热反应,降低温度,平衡正向移动.
解答 解:A.减小容器体积,压强增大,该反应为气体体积不变的反应,则平衡不移动,故A错误;
B.催化剂同等程度改变反应速率,但平衡不移动,故B错误;
C.增大c(X),促进Y的转化,Y的转化率增大,但X的转化率减小,故C错误;
D.△H<0,为放热反应,降低温度,平衡正向移动,则Y的转化率增大,故D正确;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握化学平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意温度、浓度、压强、催化剂对平衡的影响,选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
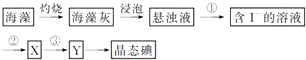

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
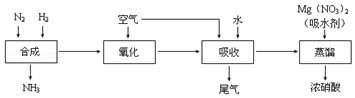
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 在该化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量 | |
| D. | 发生反应时,断开反应物中的H-H键和O-O键都要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com