
下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.不能自发进行的氧化还原反应可通过电解的原理实现
C.电镀时,电镀池里的阳极材料发生氧化反应
D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省高一上学期期中化学试卷(解析版) 题型:填空题
附加题(10分)某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下所示(写出最佳答案)

(1)沉淀的化学式:沉淀1 ,沉淀2 ,沉淀3 ;
(2)写出混合液+A的离子方程式: 。溶液+B的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高一上学期第二次阶段测试化学试卷(解析版) 题型:选择题
下列各组物质中,所含分子数相同的是
A、10g H2和10g O2
B、5.6L N2(标准状况)和11g CO2
C、9g H2O和11.2L H2O(标准状况)
D、224mL H2(标准状况)和0.1molN2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:填空题
(12分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值 (填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
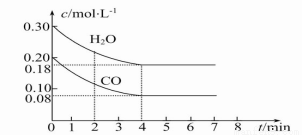
①0~4 min时间段平均反应速率v(CO)= mol·L-1·min-1。
②在800℃时该反应的化学平衡常数K= (要求写出表达式及数值),CO的转化率= 。
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol·L-1和0.80 mol·L-1,则达到平衡时CO转化为CO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
下图是电解CuCl2溶液的装置,c、d为石墨电极。则下列有关判断正确的是

A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
下列反应中符合下图图像的是

A.N2(g) + 3H2(g)  2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)
2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)
B.2SO3(g)  2SO2(g) + O2(g) ΔH = + Q2 kJ·mol-1 (Q2>0)
2SO2(g) + O2(g) ΔH = + Q2 kJ·mol-1 (Q2>0)
C.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0)
4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0)
D.H2(g) + CO(g)  C(s) + H2O(g) ΔH = + Q4 kJ·mol-1 (Q4>0)
C(s) + H2O(g) ΔH = + Q4 kJ·mol-1 (Q4>0)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
下列说法或表示法正确的
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3 kJ/mol 若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D.1 mol S完全燃烧放热297.3 kJ,热化学方程式为:S+O2===SO2 ΔH=-297.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列关于有机化合物的说法不正确的是
A.鸡蛋清中加浓硝酸微热后变黄
B.乙醇能与水任意比例混合
C.葡萄糖是一种重要的多糖
D.将苯滴入溴水中,振荡后水层接近无色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:填空题
(12分)I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体
b.适当升高温度
c.增大B的浓度
d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com