
下列关于溶液酸碱性的说法正确的是( )
A.pH=7的溶液呈中性 B.中性溶液中一定有c(H+)=10-7mol/L
C.c(H+)=c(OH-)的溶液呈中性 D.在100℃时,纯水的pH<7,因此呈酸性
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:填空题
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
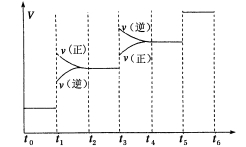
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
Ⅰ、金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图 所示。
所示。
(1)在通常状况下,金刚石和石墨相比较, (填”金刚石”或”石墨”)更稳定,石墨的燃烧热为 。
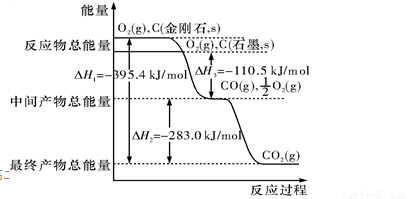
(2)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
Ⅱ、磷在氧气 中燃烧,可能生成两种固态氧化物P2O3和P2O5 , P2O5在通常状态下稳定。已知3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,放出X kJ热量。
中燃烧,可能生成两种固态氧化物P2O3和P2O5 , P2O5在通常状态下稳定。已知3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,放出X kJ热量。
(3)写出两种磷的氧化物对应的质量(g)为 、 。
(4)已知单质磷的燃烧热为Y kJ/mol,写出1mol P与O2反应生成固态P2O3的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:选择题
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
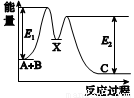
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:填空题
(1)2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1 则氢气的燃烧热为 。
(2)C(石墨) C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
(3)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,图中的括号内应填入(“+”或“-”)。

②写出表示丙烷燃烧热的热化学方程式: 。
(4)试运用盖斯定律回答下列问题:
已知:C2H5OH(g)=C2H5OH(l);△H1=- kJ/mol,
kJ/mol,
H2O(g)=H2O(l);△H2=- kJ/mol,
kJ/mol,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=- kJ/mol。
kJ/mol。
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 KJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:选择题
针对近一时期来我省部分地区发生的多起燃气事故和我市的几起燃气泄漏险情,市公用事业与房产局、市煤气总公司等多个部门和单位联合推出了安全使用燃气宣传周活动(5月28日-6月3日),倡导市民“关爱生命,安全使用燃气”。假如你在家中发现燃气(煤气或液化气等)泄漏,你首先应该做的是
A.立即关闭煤气阀门 B.立即打开排风扇
C.立即在家打电话通知煤气管理所 D.用明火查找漏气部位
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
磷在氧气中燃烧,可能生成P2O3和P2O5,已知单质磷(P)的燃烧热为X kJ/mol,0.1molP在2.24 LO2(标准状况下)燃烧至反应物耗尽时,放出Y kJ 的热量,则下列说法错误的是( )
A.生成0.025 mol P2O5
B.生成 P2O3所释放的热量为(Y-0.05X) kJ
C.2P(s)+3/2O2(g)= P2O3(s) ΔH =-(40Y-2X)kJ·mol-1
D.生成的 P2O3与 P2O5的质量之比为 1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
已知反应:2NO(g)+Br2(g) 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g) NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g) 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于丙区域的是( )

A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3Mg+N2 Mg3N2
Mg3N2
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com