
【题目】物质的量是沟通宏观与微观的桥梁,物质的量的计算在生产、生活、科技等方面具有广泛的应用。请回答下列问题:
(1)一定量的液态化合物XY2,在足量的O2中完全燃烧,反应的方程式为:XY2 (液)+3O2 (气)![]() XO2(气) +2YO2(气)。
XO2(气) +2YO2(气)。
①若参加反应的XY2的物质的量为0.01 mol,则生成的气体XO2和YO2的体积比为____;
②若测得反应后混合气体的总体积为896 mL(STP),则反应前O2的物质的量为_____。
(2)病人输液用的葡萄糖(化学式为C6H12O6)注射液,其标签上的部分内容如图所示。

①该注射液的密度为_____g/cm3;
②该注射液中葡萄糖的物质的量浓度为________。
(3)已知某无土栽培植物营养液的配方为0.3 mol KCl、0.2 molK2SO4、0.4 molNH4Cl和1 L H2O。若以KCl、(NH4)2 SO4和1 L H2O为原料配得相同组成的营养液,需(NH4)2 SO4的物质的量为__mol;KCl的物质的量为___mol。
(4)实验室为完成某实验,需要0.1 mol/L的Na2CO3溶液490 mL。
①则该同学应在托盘天平上称取__g十水碳酸钠晶体;
②配制所需Na2CO3溶液用到的玻璃仪器为_______________;
③下列实验操作造成所配溶液的浓度偏低的是______(填标号)。
A.忘记将洗涤液转移至容量瓶中 B.托盘天平的砝码生锈
C.容量瓶的内壁附有水珠而未进行干燥处理 D.定容时,俯视容量瓶的刻度线
【答案】 1:2 0.04 mol 1 0.28 mol/L 0.2 0.7 14.3 烧杯、玻璃棒、500mL容量瓶、胶头滴管(量筒) A
【解析】(1)①根据反应的方程式可知生成的气体XO2和YO2的体积比为1:2;②根据反应的方程式可知反应前后气体的体积不变,因此若测得反应后混合气体的总体积为896mL(STP),则反应前O2的体积也是896mL,物质的量为0.896L÷22.4L/mol=0.04。(2)①根据标签可判断该注射液的质量是25g÷5%=500g,所以密度为500g÷500mL=1g/mL;②根据![]() 可知该注射液中葡萄糖的物质的量浓度为
可知该注射液中葡萄糖的物质的量浓度为![]() 。(3)设需要(NH4)2SO4、KCl的物质的量分别是xmol、ymol,根据钾离子守恒可知y=0.3+0.2×2=0.7。根据硫酸根守恒可知x=0.2。(4)①需要配制500mL溶液,则该同学应在托盘天平上称取十水碳酸钠晶体的质量是0.5L×0.1mol/L×286g/mol=14.3g;②配制所需Na2CO3溶液用到的玻璃仪器为烧杯、玻璃棒、500mL容量瓶、胶头滴管(量筒);③A.忘记将洗涤液转移至容量瓶中,溶质减少,浓度偏低;B.托盘天平的砝码生锈,溶质的质量增加,浓度偏高;C.容量瓶的内壁附有水珠而未进行干燥处理不影响;D.定容时,俯视容量瓶的刻度线,溶液体积减少,浓度偏高,答案选A。
。(3)设需要(NH4)2SO4、KCl的物质的量分别是xmol、ymol,根据钾离子守恒可知y=0.3+0.2×2=0.7。根据硫酸根守恒可知x=0.2。(4)①需要配制500mL溶液,则该同学应在托盘天平上称取十水碳酸钠晶体的质量是0.5L×0.1mol/L×286g/mol=14.3g;②配制所需Na2CO3溶液用到的玻璃仪器为烧杯、玻璃棒、500mL容量瓶、胶头滴管(量筒);③A.忘记将洗涤液转移至容量瓶中,溶质减少,浓度偏低;B.托盘天平的砝码生锈,溶质的质量增加,浓度偏高;C.容量瓶的内壁附有水珠而未进行干燥处理不影响;D.定容时,俯视容量瓶的刻度线,溶液体积减少,浓度偏高,答案选A。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】有些科学家提出硅是“21 世纪的能源”,这主要是由于硅在太阳能发电过程中具有重要的作用。下列关于硅及其化合物的说法正确的是( )
A. 水泥、玻璃、水晶饰物都是硅酸盐制品
B. 光导纤维的主要成分是SiO2
C. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
D. 自然界中硅元素的贮量丰富,并存在大量的单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊巴比妥是临床常用的镇静催眠药物,它的一种同系物G的合成路线如下(部分反应条件和试剂略):
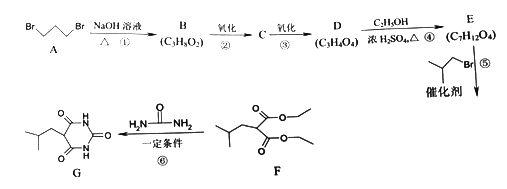
回答下列问题:
(1)化合物A的名称是__________________。
(2)化合物D中含有两个羧基,写出下列反应的化学方程式(需注明反应条件)。
反应①:___________________。
反应②:____________________。
D与乙二醇发生缩聚反应:________________。
(3)反应⑥除生成G外,另一个有机产物的结构简式为_____________。
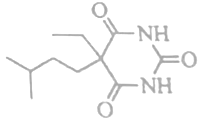
(4)反应⑤的反应类型为_____________。异戊巴比妥的结构简式如下图,与G的合成仅在起始原料和反应⑤中加入的反应物不同,则异戊巴比妥的起始原料和反应⑤中加入的反应物分别为_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图,下列说法正确的是
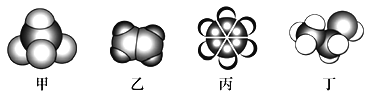
A. 甲能发生氧化反应
B. 乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应
C. 煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃
D. 丁发生催化氧化得到的产物不能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应是为了更好的利用化学反应。回答下列问题:
(1)在①置换反应 ②化合反应 ③分解反应 ④复分解反应 四种基本反应类型中,一定属于氧化还原反应的是_____________(填标号)。
(2)探究离子反应的实验装置如图。向滴有几滴酚酞的0.01 mol·L-1 Ba(OH)2溶液中逐滴滴入0.05mol·L-1 H2SO4溶液,直至过量。

①Ba(OH)2的电离方程式为__________;开始滴加0.05 mol·L-1 H2SO4时,反应的离子方程式为____________________;
②酚酞由红色变为无色时,观察到的实验现象还有____________。
(3)已知:a.向可溶性盐MnSO4的酸性溶液中加入 NaBiO3溶液,溶液变成紫红色,且有Bi3+离子生成;b.实验室常用高锰酸钾固体与浓盐酸在常温下反应制取氯气。
①写出a中反应的离子方程式________________________________;
②KMnO4、NaBiO3、Cl2的氧化性由强到弱的顺序为______________;
③某同学用盐酸酸化NaBiO3溶液,你认为是否合理,你的判定及理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为 98%)中常含有 Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图所示:
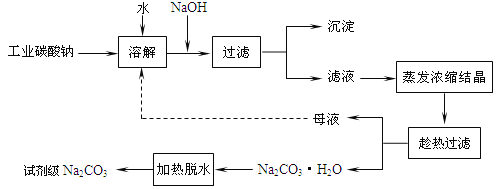
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
![]()
Ⅱ.有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10﹣9 | 6.82×10﹣6 | 4.68×10﹣6 | 5.61×10﹣12 | 2.64×10﹣39 |
(1)加入 NaOH 溶液主要为了除去 (填离子符号),发生反应的离子方程式为__________;“沉淀”的主要成份有________(填化学式);向含有Mg2+、Fe3+的溶液中滴加 NaOH 溶液,当两种沉淀共存且溶液的 pH=8 时, c(Mg2+):c(Fe3+)=_________.
(2)热的 Na2CO3 溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)__________.
(3) “趁热过滤”时的温度应控制在____________.
(4)已知:Na2CO310H2O(s)=Na2CO3(s)+10H2O(g) △H=+532.36kJmol﹣1
Na2CO310H2O(s)=Na2CO3H2O(s)+9H2O(g) △H=+473.63kJmol﹣1
写出 Na2CO3H2O 脱水反应的热化学方程式__________________.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行_______,其理由是___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为27.6 g,其中H2O的质量为10.8 g,则CO的质量是( )
A. 2.8 g B. 1.4 g C. 5.6 g D. 在2.8 g和5.6 g之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com