
| m |
| M |
| n |
| V |
| V |
| Vm |
| 1g |
| 28g/mol |
| 1 |
| 28 |
| a | ||
|
| m |
| M |
| 58.5g×20% |
| 58.5g/mol |
| n |
| V |
| 0.2mol |
| 0.1L |
| 17g |
| 17g/mol |
| 22.4L |
| 22.4L/mol |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
 【物质结构域性质】
【物质结构域性质】查看答案和解析>>
科目:高中化学 来源: 题型:
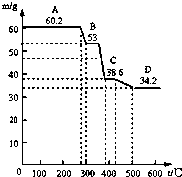 某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.
某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
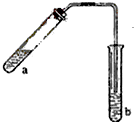 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
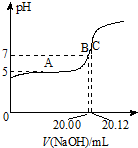 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
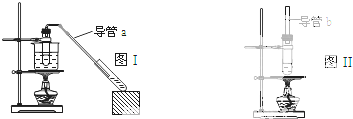
| A、制乙酸乙酯用图I装置,制乙酸丁酯用图II 装置 |
| B、导管a和导管b的作用都是冷凝回流 |
| C、都可用Na2CO3 溶液来洗去酯中的酸和醇 |
| D、加入过量的乙酸可以提高醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液加入盐酸酸化的BaCl2溶液,若生成白色沉淀,则原溶液中一定含有SO42 |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C、向FeSO4溶液中加入NaOH,可以看到先出现白色沉淀,迅速变为灰绿色,最终变成红褐色 |
| D、不能用澄清的石灰水来鉴别Na2CO3和NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com