
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是________。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他 们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
| 实验 | 酸或碱[ | 现象 |
| A | 1滴0.2 mol/L NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol/L硫酸 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是____________________________
__________________________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式_____________________________
__________________________________________________。
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g/cm3)配制浓度约为3%的H2O2溶液(密度近似为1 g/cm3)100 mL。其配制方法是:用量筒量取________mL 30% H2O2溶液放入________(填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2===2KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确________。
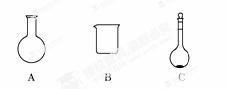
(5)实验室用二氧化锰和浓盐酸共热制取氯气,下列仪器可作为该反应的反应容器的是________(填序号)。
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH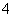 ===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)= =2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中充入N2和H2,合成NH3,到2秒末测得,v (H2) =0.45 mol / (L·s),则2秒末NH3的浓度为( )
A. 0.9 mol / L B. 0.45 mol / L C. 0.6 mol / L D. 0.55 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。
A. ①④ B. ③④ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
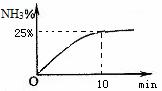 ②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式: _
此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒容的密闭容器中进行反应A(g)==B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 mol·L-1 需20 s,那么反应物由0.8 mol·L-1降到0.2 mol·L-1所需反应的时间为( )
A.10 s B.小于10 s
C.大于10 s D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成
O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表达正确的是
①次氯酸的结构式为 H—Cl—O
②含有离子键的化合物都是离子化合物
③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物
A.①②④ B.①③⑤ C.②④⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com