
【题目】“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液②是胶体③具有丁达尔现象④具有吸附性⑤浊液。其中正确的是( )
A.②③④ B.②③⑤ C.①④⑥ D.①③④⑥
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】【全国百强校.重庆市第一中学2017届高三下学期第一次月考】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
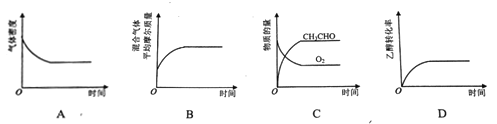
(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5, ![]() ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体进行下列反应:3X+Y ![]() 2Z,在三种不同情况下测得的速率值为:
2Z,在三种不同情况下测得的速率值为:
① v(X)=1 mol·L-1·s-1; ② v(Y)=0.5 mol·L-1·s-1; ③ v(Z)=0.5 mol·L-1·s-1。
这三种情况下反应的速率大小情况为
A. ③>②>① B. ②>①>③ C. ①>②>③ D. ③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是_____________,B是____________(填化学式) 。用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____________(填微粒浓度符号)=_____________(用含有a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_____________。
(4)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(6)现使用酸碱中和滴定法测定酸的浓度。在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测酸溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲烷是目前使用量非常大的一种清洁燃料。
(1)甲烷的电子式为_________,空间构型为__________,二氯甲烷的结构共有_____种。
(2)标准状况下,2.24L甲烷完全燃烧生成液态水和二氧化碳气体时可以放出89.1kJ的热量。请写出甲烷完全燃烧的热化学方程式_________________________________________。该燃烧反应也可设计成燃料电池,则通入甲烷的一端应该为原电池的______极。
II.1molH2(g)和1mol Cl2(g)在一定条件下反应生成2 mol HCl(g),放出184.5KJ的热量,已知断裂1molH2(g)中的H-H和1mol Cl2(g)中的Cl-Cl分别需要吸收436.4KJ和242.7KJ的能量,则1mol HCl分子中的化学键形成时释放_________KJ的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:催化剂,加热条件下通入氢气
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
③除去溴苯中少量的溴:用氢氧化钠溶液洗涤,分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
A. ①②③ B. ②③④ C. ③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com