
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )

A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有由两种金属元素组成的合金10.5g,投入足量的稀硫酸中反应完全后,测得生成氢气1g,则组成该合金的元素可能是
A. Fe与Zn B. Mg与Cu C. Na与Mg D. Al与Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用水稀释0.1 mol/L的醋酸溶液,随加水量的增加而增大的是( )
A.n(CH3COOH) B.c(H+) C. c(H+) ·c(OH-) D. c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。

查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的______(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为______。
(2)欲收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为:a→______→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):

(3)实验室也可用B装置制备NO,与B装置相比,使用X 装置的优点为______。
(4)组装好实验装置后应先______,然后装入药品。一段时间后,两种气体在Z中反应的现象为______。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10 g溶于水,配制成250 mL溶液;取出25.00 mL,以K2CrO4溶液为指示剂,用0.8 mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50 mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的离子方程式为______。
(6)亚硝酰氯(ClNO)的质量分数为______。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
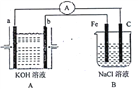
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。

①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
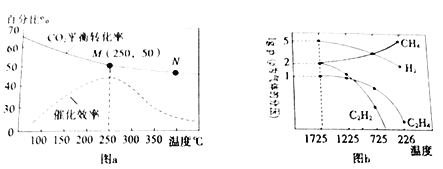
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com