
����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 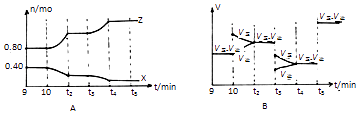
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��
���𰸡�
��1��X+2Y?2Z
��2��50%��0.07mol/��L?min��
��3��80L/mol
��4������
��5������Y��Ũ�ȣ������¶ȣ��Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶����������
���������⣺��1���ɱ������ݿ�֪��X��YΪ��Ӧ�ZΪ�����1minʱ��n��X��=0.8mol��0.7mol=0.1mol����n��Y��=1mol��0.8mol=0.2mol����n��X������n��Y��=1��2��10min������ʵ����ʵ������ٱ仯����Ӧ�ﲻΪ0����Ϊ���淴Ӧ����ʱ��n��X��=0.8mol��0.4mol=0.4mol�����n��Y��=0.8mol����n��Z��=0.8mol���ٸ������ʵ����仯��֮�ȵ��ڻ�ѧ������֮�ȣ���n��X����n��Y����n��Z��=0.4mol��0.8mol��0.8mol=1��2��2����Ӧ����ʽΪX+2Y2Z�����Դ��ǣ���Ӧ����ʽΪX+2Y2Z����2���ɱ������ݿ�֪��10minʱ����n��X��=0.8mol��0.4mol=0.4mol����X��ת����Ϊ�� ![]() =50%����ӦX+2Y2Z��0��5min�ڣ�Z�ķ�Ӧ����Ϊ��
=50%����ӦX+2Y2Z��0��5min�ڣ�Z�ķ�Ӧ����Ϊ�� ![]() =0.07mol/��Lmin������Ӧ����֮��=��ѧ������֮�ȣ���Y�ķ�Ӧ����Ϊ��0.07mol/��Lmin�������Դ��ǣ�50%�� 0.07mol/��Lmin����
=0.07mol/��Lmin������Ӧ����֮��=��ѧ������֮�ȣ���Y�ķ�Ӧ����Ϊ��0.07mol/��Lmin�������Դ��ǣ�50%�� 0.07mol/��Lmin����
3���������ݣ���
X+ | 2Y | 2Z | ||
��ʼ���� | 0.8 | 1 | 0 | |
ת������ | 0.4 | 0.8 | 0.8 | |
ƽ������ | 0.4 | 0.2 | 0.8 |
��k= ![]() =80 L/mol�����Դ��ǣ�80 L/mol����4���¶Ȳ��䣬k���䣬X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol����ʱQc=
=80 L/mol�����Դ��ǣ�80 L/mol����4���¶Ȳ��䣬k���䣬X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol����ʱQc= ![]() ��80����Ӧ������������У���v����v�������Դ��ǣ����ڣ���5���ٷ���ͼ��A��10minʱ��X���٣�Z���࣬ͼ��B��Ӧ�����������ƶ���Ϊ����Y��Ũ�ȣ����Դ��ǣ�����Y��Ũ�ȣ� ��t3��Ӧ��������Ӧ�����ƶ�����Ӧ���ʾ�������Ӧ���ǽ����¶ȣ�t5ʱ��Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ���������Ӱ��ƽ�⣬��Ϊ�Ӵ��������Դ��ǣ����»��¶ȣ�ʹ�ô��� ���ô�����Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶���������ȣ�
��80����Ӧ������������У���v����v�������Դ��ǣ����ڣ���5���ٷ���ͼ��A��10minʱ��X���٣�Z���࣬ͼ��B��Ӧ�����������ƶ���Ϊ����Y��Ũ�ȣ����Դ��ǣ�����Y��Ũ�ȣ� ��t3��Ӧ��������Ӧ�����ƶ�����Ӧ���ʾ�������Ӧ���ǽ����¶ȣ�t5ʱ��Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ���������Ӱ��ƽ�⣬��Ϊ�Ӵ��������Դ��ǣ����»��¶ȣ�ʹ�ô��� ���ô�����Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶���������ȣ�
�����㾫����������Ҫ�����˻�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ��CO2��H2��CO�Ļ�������뵪�����ܶ���ͬ����û��������CO2��H2��CO������֮�ȿ���Ϊ�� ��
A.13��8��27
B.13��9��27
C.26��16��27
D.286��8��27
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� �� 
A.Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ��ͼһ��ʾ��ʯī�缫�ϲ���������ͭ�缫����������Ӧ
B.ͼһ��ʾ����0.1mol����ת��ʱ����0.1mol Cu2O����
C.ͼ��װ���з�����Cu+2Fe3+�TCu2++2Fe2+ �� X���Ǹ�����Y�����Ͽ�����ͭ
D.��ͼ�������ŵ������Ǵ��ݵ����ά�ֵ��ƽ�⣬Fe3+�������Ž�������ձ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NF3����һ����ɫ����ζ�����壬�������ӹ�ҵ�����Ĺؼ�ԭ��֮һ�����ɰ����ͷ�����Ӧ�õ���4NH3+3F2�TNF3+3NH4F���ڳ�ʪ�Ŀ����У�NF3����ˮ��������������ԭ��Ӧ���䷴Ӧ�IJ�����HF��NO��HNO3 �� ����˵����ȷ���ǣ� ��
A.��ȡNF3�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ3��1
B.��NF3��H2O�ķ�Ӧ�У�H2O����ԭ��
C.������ȡNF3�ķ�Ӧ����0.5 mol NH3�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ3 mol
D.NF3�ڿ�����һ��й©�������ڷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��MgSO4������Fe��Al�������Ϊԭ���Ʊ�MgCO33H2O��ʵ�������ͼ1 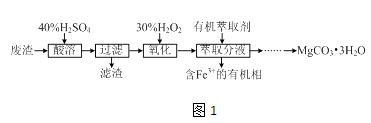
��1����������ȵ�Ŀ����������ʱ�õ��IJ���������
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ ��
��3������ͼ2��ʾ��ʵ��װ�ý�����ȡ�ͷ�Һ���Գ�ȥ��Һ�е�Fe3+ �� 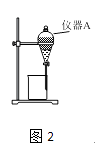
��ʵ��װ��ͼ2������A������Ϊ ��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ����Һ������A�м���һ�������л���ȡ���������á���Һ�����ظ���Σ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����m����bĦ/��AlCl3��Һ�м�������aĦ/��NaOH��Һ��
��1����0��a��3bʱ������Al(OH)3���������ʵ�����_______________��
��2���� a��3bʱ�� ���ɳ��� _______ ��
��3����a��b����___________����ʱ���������ɡ�
��4����3b��a��4bʱ���г������ɣ�����Al(OH)3������������__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ���й��Ŵ��Ĵ���֮һ������ǡ�������ľ̿�۾��Ȼ�϶��ɣ���ȼ����ܷ����ķ�Ӧ��S+2KNO3+3C=N2��+3CO2��+X������ƽ����������X��
A. K2S B. SO2 C. H2S D. SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ﳣ��Na2O2��H2O��Ӧ������ȡ������O2������װ��������ȡO2����ʾNa��O2�е�ȼ��ʵ�顣
��1���ر�װ���е�ֹˮ��a��������b��©����Һ�岻�ϵ����µΣ�ֱ��ȫ�������Թܡ����ж�װ���Ƿ�©��________(����©����������©���� ������ȷ����)
��2��д��Cװ���з�Ӧ�Ļ�ѧ����ʽ��_________
��3����װ���Dz�©���ģ���ֹˮ��a��������װ�ý���ʵ�顣д��A�з�����Ӧ�Ļ�ѧ����ʽ������˫���ű�����ϼ۱仯���������ת�Ƶķ������Ŀ����������ԭ��� _________
��4��Bװ����ʢ�ŵ��Լ���__________����������___________ D���������� _____
��5��Fe(OH)2 �ڳ�ʪ�����б�ɻ���ɫ�����ɫ��_________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����MgCl2��AlCl3�����Һ������ʼ�μ�7 mL�Լ�A��֮��ĵμ��Լ�B�����ó������ʵ���y (mol) ���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ��(�Լ�A��B�ֱ���NaOH ��Һ�����е�һ��)
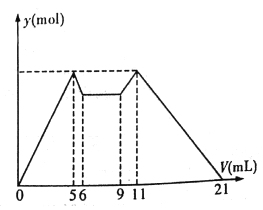
���½��۲���ȷ����
A. A��NaOH ��Һ��B������
B. ԭ���Һ����c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. ��6 ��9 �Ĺ������������ķ�Ӧ�����ӷ�Ӧ����ʽ��H+ +OH-=H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com