
| A、同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN |
| B、物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) |
| C、0.1mol?L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| D、体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
 已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(l);△H═-1135.7kJ/mol |
| B、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(g);△H═-1000.3kJ/mol |
| C、N2H4(g)+NO2(g)═3/2 N2(g)+2 H2O(l);△H═-1135.7kJ/mol |
| D、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(g);△H═-1135.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、醋酸溶液和大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NH4Al(SO4)2溶液中滴加少量的NaOH:NH4++OH-=NH3?H2O |
| D、向Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 改变条件 | 新平衡与原平衡比较 | |
| A | 升高温度 | X的转化率变小 |
| B | 增大压强 | X的浓度变小 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、K+、ClO-、Cl- |
| B、Ag+、Na+、Cl-、NO3- |
| C、NH4+、K+、CO32-、Br- |
| D、H+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液中加入少量KAl(SO4)2溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
| B、FeCl3溶液中加入Cu粉:Fe3++Cu=Fe2++Cu2+ |
| C、将适量SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、向a mol FeBr2溶液中通入1.5amolCl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
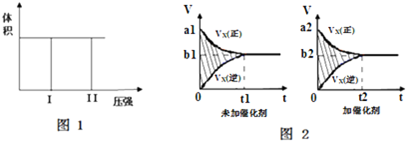
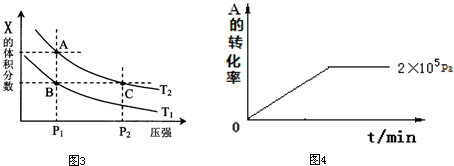
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
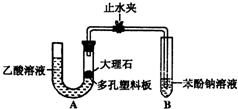 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. -ONa溶液的pH,其pH由大到小排列的顺序为
-ONa溶液的pH,其pH由大到小排列的顺序为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com