
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
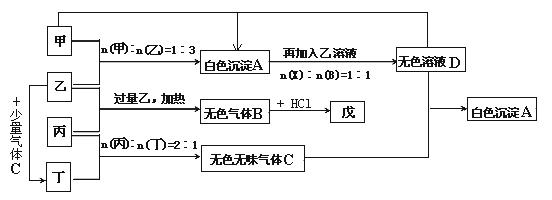
浙江之星课时优化作业系列答案科目:高中化学 来源:不详 题型:填空题
 ____________ _____ 阴极:____________ __________
____________ _____ 阴极:____________ __________查看答案和解析>>
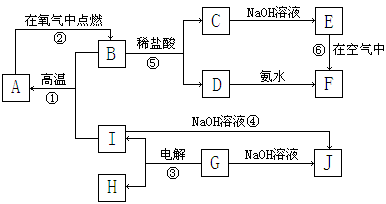
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
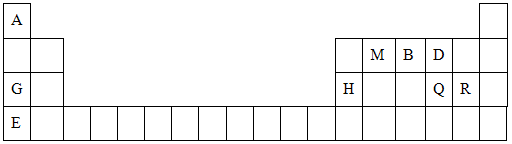
科目:高中化学 来源:不详 题型:填空题
 ,该化合物与CA3和A2D的熔点由高到低的顺序为 (用化学式表示)。
,该化合物与CA3和A2D的熔点由高到低的顺序为 (用化学式表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
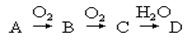
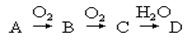 方程式表示其原因:
方程式表示其原因:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是 。
是 。 的溶液作用下,可形成燃料电池,则该电池的负极反应式为 。
的溶液作用下,可形成燃料电池,则该电池的负极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
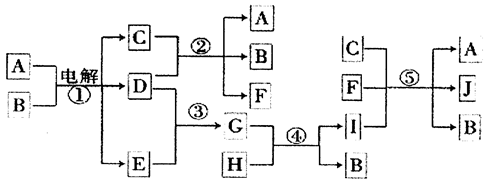
 __________________。
__________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com