
化学科学需要借助化学专用语言来描述,下列有关化学用语不正确的是
A.甲烷分子的球棍模型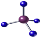 B.Cl—的结构示意图
B.Cl—的结构示意图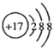
C.中子数为8的碳原子的核素符号为12C D.中子数为1的氢原子的核素符号为21H
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组为
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
A | CCl4 | Br2 | 用NaOH溶液洗涤、分液 |
B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.28gFe与0.5 molCl2充分反应转移电子数为1.5NA
B.常温常压下,19 g D3O+含有10 NA个电子
C.室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA
D.25℃时,1 L pH =12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列反应属于吸热反应的是
A.木炭的燃烧 B.氢氧化钡晶体与氯化铵晶体混合
C.镁条与稀硫酸的反应 D.生石灰溶于水
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
K4[Fe(CN)6]强热可发生反应:3K4[Fe(CN)6] 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
(1)基态铁原子价层电子排布式为____________,组成K4[Fe(CN)6]的几种元素第一电离能由大到小的顺序为___________,K4[Fe(CN)6]中配离子组成为___________。
(2)(CN)2分子中各原子均达到稳定的电子层结构,则碳原子杂化轨道类型为___________,分子中含有σ键与π键数目比为___________,分子构型为_____________。
(3)KCN沸点1497℃,熔点563℃,则其晶体类型为___________,与NaCN相比,熔点较高的物质是___________。
(4)碳可形成多种单质,下图是碳的三种单质与氧化石墨烯的结构示意图。
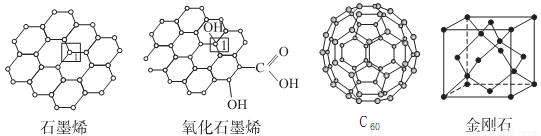
①若将10nm石墨烯与氧化石墨烯粒子在相同条件下分散到水中,所得到的分散系中,后者的稳定性强于前者,可能的原因是___________。
②1mol石墨烯含有的6元环有___________NA,上述四种物质中,___________的化学性质明显不同于另外几种物质。
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:推断题
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:

(1)向酚酞试液中加入化合物A的粉末,现象为___________。
(2)单质甲与化合物B反应的离子方程式为___________。5.05g单质甲—钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为___________。
(3)向20mL某浓度的化合物C的溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况.
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为___________。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为___________。
③原化合物C溶液的物质的量浓度为___________。
④由A、B可知,两次实验通入的CO2的体积比为___________。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:填空题
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
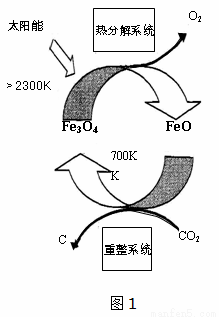
(1)国外学者提出的由CO2制取C的太阳能工艺如图1所示
①“热分解系统”发生的反应为2Fe3O4 6FeO + O2↑,每分解1molFe3O4 转移的电子数为_________。
6FeO + O2↑,每分解1molFe3O4 转移的电子数为_________。
②“重整系统”发生反应的化学方程式为_________________。
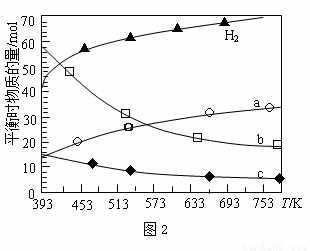
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g) +6H2(g) 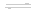 C2H4(g) + 4H2O(g) △H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g) + 4H2O(g) △H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①曲线b表示的物质为__________(写化学式)。②该反应的△H ______0(填:“>”或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是____(列举1项)。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如题图3所示。
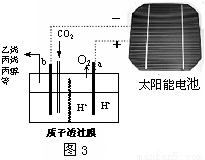
①该工艺中能量转化方式主要有________________(写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生。下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,3v(N2)正=v(H2)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com