
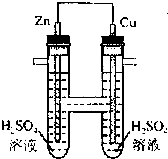
| A.正极发生氧化反应 |
| B.电子通过导线由铜流向锌 |
| C.负极有O2逸出 |
| D.铜上有H2逸出 |
科目:高中化学 来源:不详 题型:单选题
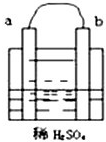
| A.碳棒上有气体放出,溶液的pH增大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极流到b极 |
| D.a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.氢离子在铜表面被还原,产生气泡 |
| B.电流从锌片经导线流向铜片 |
| C.电子从锌片经导线流向铜片 |
| D.锌是负极,其质量逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
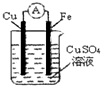
| A.铁棒为正极 |
| B.铜棒上发生还原反应 |
| C.铁棒质量增加 |
| D.电流从铁棒经外电路流向铜棒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
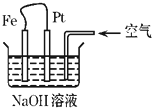
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置 |
| C.Pt为负极,其电极反应为:O2+2H2O+4e-═4OH- |
| D.Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
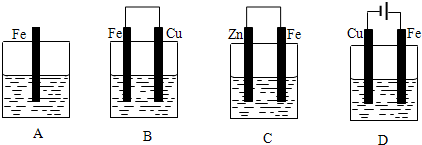
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
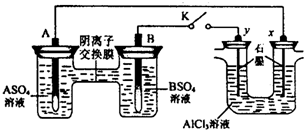
| A.溶液中c(A2+)浓度减小 |
| B.B的电极反应:B-2e-═B2+ |
| C.y电极上有H2产生,发生还原反应 |
| D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
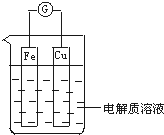
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。 O(g)△H2=-1160 kJ·mol-1
O(g)△H2=-1160 kJ·mol-1 (2)脱碳。将CO2转化为甲醇的热化学方程式为:
(2)脱碳。将CO2转化为甲醇的热化学方程式为: CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3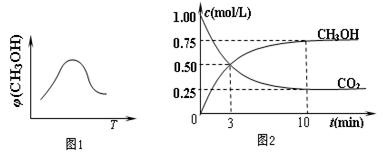
 器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是 (填字母代号)。
器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是 (填字母代号)。| A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)="1.5" mol/L |
| B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com