
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
| m |
| V |
| n |
| V |
| m |
| V |
| 0.6mol |
| 2L |
| 2.4mol |
| 3mol |


科目:高中化学 来源: 题型:
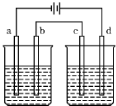 按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )
按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )| 选项 | 左池 | 右池 |
| A | KCl | Cu(NO3)2 |
| B | AgNO3 | CuSO4 |
| C | NaCl | AgNO3 |
| D | KOH | CuSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、C的体积分数增加 |
| C、平衡向正反应方向移动 |
| D、A 的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:| 实验 编号 | 温度/K | 盐酸浓度 /mol?L-1 | 醋酸浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 0.20 | |||
| ⑤ | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B | C | D |
| 实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
| 分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
| 选用仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com