
【题目】有下列高分子化合物:
① ②
②![]() ③
③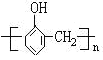 ④
④![]() ⑤
⑤
其中由两种不同单体聚合而成的是( )
A.仅③⑤B.仅③④⑤C.仅①②③⑤D.仅②③④⑤
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是
A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式__________________________________________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
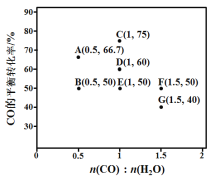
①经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=__________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是_____
②对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是________
③比较A、B两点对应的反应速率大小:VA________VB(填“<” “=”或“>”)。反应速率v=v正v逆= K正X(CO)![]() X(H2O) –K逆X( CO2)
X(H2O) –K逆X( CO2)![]() X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中 =________(列出计算式)。
=________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是________。
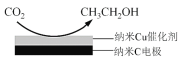
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某卤代烃与NaOH的醇溶液共热,产生的气体在标准状况下的体积为896mL,同时得到溶液100mL。取出10mL溶液先用HNO3酸化后再加入AgNO3溶液直到不再产生白色沉淀为止,用去0.1mol·L-1AgNO3溶液40mL;所得气体完全燃烧时消耗O20.18mol。则该有机物的结构简式为________,名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】衣康酸是一种重要的有机化学中间体,可通过下列方法合成:

①B→C的反应类型__________。
②有机物A可能的结构简式为__________。
③D发生加聚反应所得有机物的结构简式为__________。
④写出同时满足下列条件的C的一种同分异构体E的结构简式:__________。
Ⅰ.能与盐酸反应;
Ⅱ.E为五元环状化合物,分子中有4种不同化学环境的氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机样品(仅含C、H、O三种元素)3.0g在足量O2中完全燃烧,将燃烧后的混合物先通过足量的浓硫酸,浓硫酸增重1.8g,再通过足量的澄清石灰水,经过滤得到10g沉淀。该有机样品的组成可能是(括号内给出的是有机物的分子式)( )
A.葡萄糖(C6H12O6)与蔗糖(C12H22O11)
B.醋酸与甲酸甲酯(C2H4O2)
C.乙醇与甲醛(CH2O)
D.二甲醚(C2H6O)与乳酸(C3H6O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变,0.1mol/L甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )
已知:δ(RCOOH)=![]()
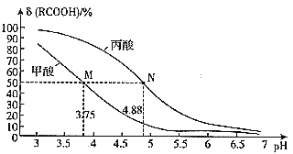
A.等浓度的HCOONa和CH3CH2COONa两种溶液中水的电离程度比较:前者>后者
B.将等浓度的HCOOH溶液与HCOONa溶液等体积混合,所得溶液中:c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.图中M、N两点对应溶液中的Kw比较:前者>后者
D.1mol/L丙酸的电离常数K﹤10-4.88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)2NO2(g)△H,上述反应分两步完成,其反应历程如图1所示, 回答下列问题:
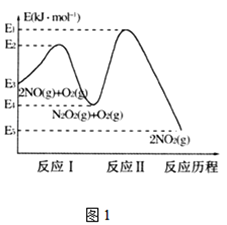
①写出反应I的热化学方程式________________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)![]() N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
②计算反应达到第一次平衡时的平衡常数K=____________。
③第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
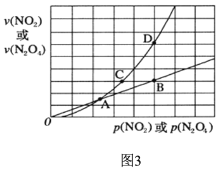
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com