
 全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S
全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S| 放电 |
| 充电 |
| A、乙池溶液中的N03一移向铁电极 |
| B、乙池石墨电极反应式为Ag++e-=Ag |
| C、甲池充电时,锂电极发生氧化反应 |
| D、甲池中消耗14g锂,乙池中产生11.2L氧气《标准状况下) |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| A、苯和乙烯都可以使得溴的四氯化碳溶液褪色 |
| B、等物质的量的乙烯和乙醇完全燃烧消耗氧气的量不相等 |
| C、乙醇的酯化反应和酯的水解反应均属于取代反应 |
| D、聚乙烯可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
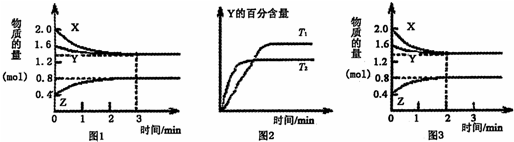
| A、容器中发生的反应可表示为:3X(g)+Y(g)?4Z(g) |
| B、0-3 min内,v(X)=0.2 mol?L-1?min-1 |
| C、若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
| D、其他条件不变升高温度,v正、v重都增大,且重新达到平衡前v正>v重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
| A、v(H2)=3v(CO2)、v逆(CO2)=v正(CH3OH) |
| B、升高温度或减小压强均可使平衡常数增大 |
| C、0~3s内用H2表示的平均反应速率是0.05mol?L-1?s-1 |
| D、增大CO2浓度或选择适当的催化剂均能使该反应的反应速率增大,且平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:K>Na>Li |
| B、热稳定性:HI>HCl>HF |
| C、非金属性:F>O>N |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com