
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
 如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液
如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁烯、丙烷 |
| B、乙炔(C2H2)、乙烯 |
| C、乙炔、丙烷 |
| D、乙烷、环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
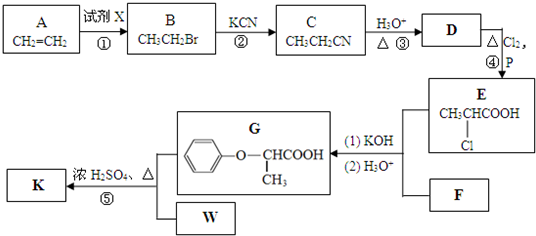
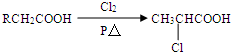
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制标准溶液所用的氢氧化钠已经潮解 |
| B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C、未用标准液润洗碱式滴定管 |
| D、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A-)≧c(M+) |
| B、c(A-)=c(M+) |
| C、若MA不水解,则c(OH-)<c(H+) |
| D、若MA水解,则c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6和C3H8 |
| B、C5H10和C6H6 |
| C、C2H6O和C2H4O2 |
| D、C4H8和C3H8O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com