
(12分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是________(填序号,错选倒扣分)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:
v(CH3OH)=nA /tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
(本题共15分)空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示。

(1)步骤一中的CaO俗称 。
(2)步骤二中发生反应的化学方程式是 ,该反应 (填“是”或“不是”)步骤一中反应的逆反应。
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如右图所示。

(1)NaOH溶液喷成雾状是为了 。
(2)右图a环节中,物质分离的基本操作是 。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和 。
下列溶液中,同样能用于“捕捉”二氧化碳的是( )。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
研究发现,上述两种方法虽然在化学原理上都是可行的,但在实际应用中仍存在很多问题,例如:( )。
①方法Ⅰ将受到地域的限制
②方法Ⅱ的能耗太大
③方法Ⅰ中使用的是氧化钙颗粒而不是氧化钙粉末
④方法Ⅱ中的物质可以循环利用,但方法Ⅰ中的却不能
A.①③ B.①② C.②④ D.③④
“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是 (用化学方程式表示)。
可见,要真正实现“碳捕捉”和“碳封存”的设想,科学家任重而道远。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是________(填序号,错选倒扣分)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:
v(CH3OH)=nA/tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(本题共15分)空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
1.方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示。
(1)步骤一中的CaO俗称 。
(2)步骤二中发生反应的化学方程式是 ,该反应 (填“是”或“不是”)步骤一中反应的逆反应。
2.方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如右图所示。
(1)NaOH溶液喷成雾状是为了 。
(2)右图a环节中,物质分离的基本操作是 。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和 。
3.下列溶液中,同样能用于“捕捉”二氧化碳的是( )。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
4.研究发现,上述两种方法虽然在化学原理上都是可行的,但在实际应用中仍存在很多问题,例如:( )。
①方法Ⅰ将受到地域的限制
②方法Ⅱ的能耗太大
③方法Ⅰ中使用的是氧化钙颗粒而不是氧化钙粉末
④方法Ⅱ中的物质可以循环利用,但方法Ⅰ中的却不能
A.①③ B.①② C.②④ D.③④
5.“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是 (用化学方程式表示)。
可见,要真正实现“碳捕捉”和“碳封存”的设想,科学家任重而道远。
查看答案和解析>>
科目:高中化学 来源:2010年普通高等学校招生全国统一考试(上海卷)理综化学部分 题型:填空题
(本题共15分)空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
1.方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示。
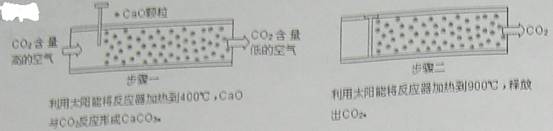
(1)步骤一中的CaO俗称 。
(2)步骤二中发生反应的化学方程式是 ,该反应 (填“是”或“不是”)步骤一中反应的逆反应。
2.方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如右图所示。
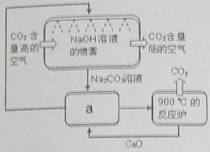
(1)NaOH溶液喷成雾状是为了 。
(2)右图a环节中,物质分离的基本操作是 。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和 。
3.下列溶液中,同样能用于“捕捉”二氧化碳的是( )。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
4.研究发现,上述两种方法虽然在化学原理上都是可行的,但在实际应用中仍存在很多问题,例如:( )。
①方法Ⅰ将受到地域的限制
②方法Ⅱ的能耗太大
③方法Ⅰ中使用的是氧化钙颗粒而不是氧化钙粉末
④方法Ⅱ中的物质可以循环利用,但方法Ⅰ中的却不能
A.①③ B.①② C.②④ D.③④
5.“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是 (用化学方程式表示)。
可见,要真正实现“碳捕捉”和“碳封存”的设想,科学家任重而道远。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com