
【题目】下列说法正确的是
A.将铁粉加入![]() 、
、![]() 混合溶液中,充分反应后剩余的固体中必有铁
混合溶液中,充分反应后剩余的固体中必有铁
B.将![]() 和
和![]() 混合气体分别通入
混合气体分别通入![]() 溶液、
溶液、![]() 溶液中,最终都有沉淀生成
溶液中,最终都有沉淀生成
C.检验某酸性溶液中![]() 和
和![]() ,选用试剂及顺序是过量
,选用试剂及顺序是过量![]() 溶液、
溶液、![]() 溶液
溶液
D.用加热分解的方法可将![]() 固体和Ca(OH)2固体的混合物分离
固体和Ca(OH)2固体的混合物分离
【答案】C
【解析】
A.将铁粉加入FeCl3 、CuCl2 混合溶液中,发生的反应为:Fe + 2Fe3+ = 3Fe2+,Fe + Cu2+ =Fe2+ +Cu,铁的还原性大于铜,充分反应后剩余的固体为铜或铁和铜的混合物,必有铜,选项A错误;
B.CO2和SO2混合气体分别通入BaCl2溶液无沉淀生成,CO2和SO2和氯化钡溶液不反应,二氧化硫通入Ba(NO3)2溶液中,有硫酸钡沉淀生成,选项B错误;
C.酸性溶液排除碳酸根离子、亚硫酸根离子的干扰,若先加AgNO3溶液,则硫酸根离子也会沉淀,不能检验氯离子,所以先加过量Ba(NO3)2溶液使硫酸根离子沉淀完全,再加AgNO3溶液,可以检验某酸性溶液中Cl-和SO42-,选项C正确;
D.氯化铵受热分解生成氨气和氯化氢,遇冷又结合成氯化铵固体,无法分离NH4Cl固体和Ca(OH)2固体,选项D错误;
答案选C。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】银精矿(其化学成分有:Ag、Zn、Cu、Pb、S 及 SiO2 等)从其中提取银及铜和铅的工艺流程如图:

回答下列问题:
(1)“浸取”时,当盐酸的浓度和 KClO3 的量一定时,为提高浸取率可采取的措施是______(请用简练语言列举一项)。
(2)“分离Ⅰ”所加试剂 X 为______,“分离Ⅱ”所得滤渣中除含单质硫外,还含有的成分有______。
(3)“浸银”反应的化学方程式为______
(4)N2H4 的电子式为______,“还原”反应的离子方程式为______。
(5)“粗银”(含 Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是______(写出一条即可)。
(6)此类工厂排出的废水中含有 NO3-,对人体有害。科技人员在碱性条件下用 Al 粉将 NO3-还原为 N2。缺点是处理后的水中引入了 AlO2-,仍然对人体健康有害。
已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 Al(OH)3H+ + AlO2- + H2O K=1.0×10-13
①25℃时,欲将上述处理过水中的 AlO2- 浓度降到 1.0×10-6 mol/L,此时水中 c(Al3+)=______mol/L。
②25℃时,Al(OH)3 溶于 NaOH 溶液反应的平衡常数 K=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是
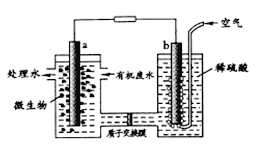
A. a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
B. 质子交换膜处H+由右向左移动
C. 该电池在微生物作用下将化学能转化为电能
D. 开始放电时b极附近pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/ mol。
2NO2(g) ΔH=+24.4 kJ/ mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是____
a v正(N2O4)=2v逆(NO2) b 体系颜色不变
c 气体平均相对分子质量不变 d 气体密度不变
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式_________(用p总、各气体物质的量分数用x表示);
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×104s-1,当N2O4分解10%时,v正=_______kPa·s-1。(结果保留两位有效数字)
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由反应![]() ,可知
,可知![]() 是碱性氧化物
是碱性氧化物
B.![]() 通入品红溶液,溶液褪色的原理与
通入品红溶液,溶液褪色的原理与![]() 通入溴水后褪色的原理相同
通入溴水后褪色的原理相同
C.由反应![]() ,可知生成
,可知生成![]() 能降低
能降低![]() 的浓度
的浓度
D.由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素![]() 和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下
和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下![]() 的B溶液的
的B溶液的![]() ,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
A.化合物C可能为离子化合物
B.Z离子的半径比Y离子的大
C.Y的非金属性很强,其单质非常活泼
D.氧化物的水化物的酸性:Y比W强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
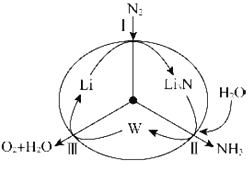
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
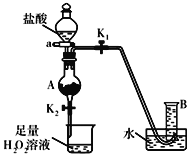
A.烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.B中收集到的气体是氢气
D.反应后的烧杯中通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
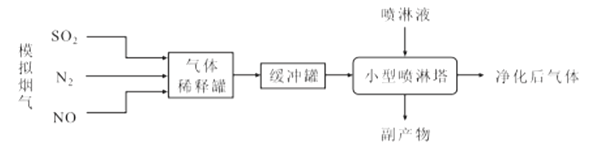
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com