
分析 (1)卤水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+与OH-反应生成Mg(OH)2,
(2)①灼烧Mg(OH)2 得到MgO与水;
②由题目信息可知,Si与MgO反应生成Mg(蒸汽),同时生成二氧化硅;
(3)①从溶液得到晶体,需要经过加热浓缩、冷却结晶、过滤等操作;
②MgCl2•6H2O与SOCl2混合后加热,可获得无水MgCl2与SO2,由元素守恒与白雾现象可知生成HCl;
(4)①三硅酸镁可以看作MgO、SiO2的混合物,MgO与HCl反应生成氯化镁与水,利用原子守恒配平;
②硫酸与氧化镁、氢氧化钠反应生成MgSO4、Na2SO4,根据硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4),由钠离子守恒2n(Na2SO4)=n(NaOH),联立计算n(MgSO4),再根据Mg原子守恒计算x的值.
解答 解:(1)利卤水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+与OH-反应生成Mg(OH)2,反应离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,
故答案为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(2)①灼烧Mg(OH)2 得到MgO与水,化学方程式为:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
故答案为:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
②由题目信息可知,Si与MgO反应生成Mg(蒸汽),同时生成二氧化硅,反应方程式为:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2,
故答案为:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2;
(3)①从溶液得到晶体,需要经过加热浓缩、冷却结晶、过滤等操作,
故答案为:加热浓缩、冷却结晶;
②MgCl2•6H2O与SOCl2混合后加热,可获得无水MgCl2与SO2,由元素守恒与白雾现象可知生成HCl,反应方程式为:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑,
故答案为:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑;
(4)①三硅酸镁可以看作MgO、SiO2的混合物,MgO与HCl反应生成氯化镁与水,配平后离子方程式为:xMgO•3SiO2+2xH+=xMg2++3SiO2+xH2O,
故答案为:2x;x;3;xH2O;
②硫酸与氧化镁、氢氧化钠反应生成MgSO4、Na2SO4,根据硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4)=0.5000mol/L×0.015L=0.0075mol,由钠离子守恒2n(Na2SO4)=n(NaOH)=0.5000mol/L×0.014L=0.007mol,则n(Na2SO4)=0.0035mol,故n(MgSO4)=0.004mol,则$\frac{0.004}{x}$×[40x+3×(32+28)]=0.52,解得x=2,
故答案为:2.
点评 本题考查实验制备原理、物质组成的测定、物质的分离提纯、滴定原理应用等,侧重对原理中化学方程式的考查,是对学生综合能力的考查,难度中等.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素W:位于元素周期表中的第三周期,ⅢA族 | |
| B. | 元素X:它的原子中M层比L层少2个电子 | |
| C. | 元素Y:它的焰色反应颜色呈黄色 | |
| D. | 元素Z:它的二价阳离子核外电子总数与氩原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
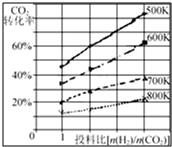 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 可逆反应达到平衡时,逆反应便立即停止了 | |
| D. | 温度发生变化,上述的K值也发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
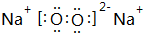 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com