
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
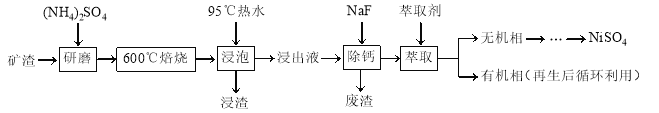
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
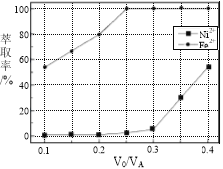
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
【答案】(1)增大接触面积,加快反应速率,使反应更充分;
(2)Fe3++2H2O![]() FeO(OH)↓+3H+,SiO2、CaSO4;
FeO(OH)↓+3H+,SiO2、CaSO4;
(3)0.5,Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O;(4)2.0×10-3;(5)0.25。
2Cr3++6Fe3++7H2O;(4)2.0×10-3;(5)0.25。
【解析】
试题分析:(1)混合研磨,增大接触面积,加快反应速率,使反应更充分;(2)放在95℃热水中浸泡,使Fe3+发生水解,即离子反应方程式为:Fe3++2H2O![]() FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒,n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+)/n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价降低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,升高1价,最小公倍数为6,因此离子反应方程式为:Cr2O72-+6Fe2++14H+
FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒,n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+)/n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价降低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,升高1价,最小公倍数为6,因此离子反应方程式为:Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+)=1.0×10-3×1%mol·L-1=1.0×10-5mol·L-1,Ksp=c(Ca2+)×c2(F-),c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25。
2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+)=1.0×10-3×1%mol·L-1=1.0×10-5mol·L-1,Ksp=c(Ca2+)×c2(F-),c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢钙溶液中加入足量的氢氧化钠溶液:Ca2++2HCO![]() +2OH-= CaCO3↓+CO
+2OH-= CaCO3↓+CO![]() +2H2O
+2H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C. 向氢氧化钠溶液中滴入少量硫酸铝溶液:Al3+ +3OH- = Al(OH)3↓
D. 钠与CuSO4溶液反应:2Na + Cu2+ = 2Na+ + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A. H2SO4是酸,因为H2SO4中含有氢元素
B. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. 燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
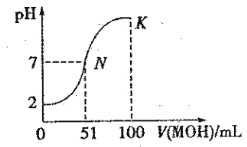
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,常用作耐火材料D是一种红棕色固体,可用作涂料。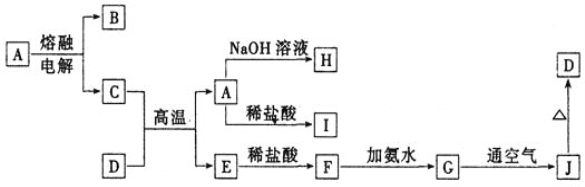
回答下列问题:
(1)A物质的名称为___________,D的化学式为_________。
(2)G→J的反应现象为______________其化学方程式为:_______________
(3)写出下列离子方程式:A→H_______________________
F→G _____________________
(4)写出C+D→A+E的化学方程式为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有![]() 溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。
溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。
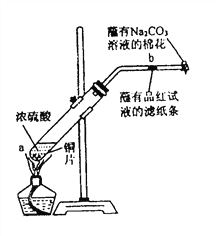
回答下列问题:
(1)写出a处反应的化学方程式____________________________________________。
(2)试管中的液体反应一段时间后,![]() 处滤纸条的变化为_____________。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_______。
处滤纸条的变化为_____________。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_______。
(3)待试管中液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察溶液呈______色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是____________
(5)如果浓硫酸的浓度为![]() ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为![]() 。则浓硫酸的实际体积_____________(填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积_____________(填写“大于”、“等于”或“小于”)![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com