
| 盐酸 |
| Ⅰ |
| 蒸馏 |
| Ⅱ |
| 水 |
| Ⅲ |
| Zn |
| Ⅳ |
| 蒸馏 |
| Ⅱ |
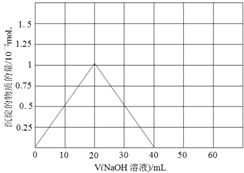 ;
; ;
;| 蒸馏 |
| Ⅱ |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
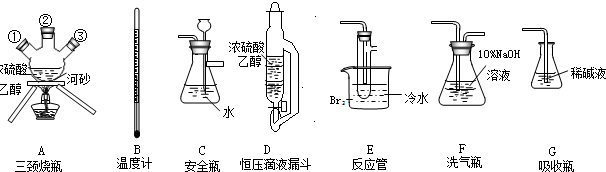
查看答案和解析>>
科目:高中化学 来源: 题型:

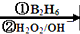 R-CH2CH2OH;
R-CH2CH2OH;查看答案和解析>>
科目:高中化学 来源: 题型:
| X | A | |
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、A、B的氢化物的稳定性:A>B |
| C、Y、C的最高价氧化物对应水化物的酸性:Y<C |
| D、B、C简单阴离子的还原性强弱为:B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 热化学方程式 | 结 论 | |
| A | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | 氢气的燃烧热为241.8kJ/mol |
| B | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C | 2C(s)+2O2(g)=2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)=2CO(g)△H=-b kJ/mol | b>a |
| D | C(石墨,s)=C(金刚石,s)△H=+1.5kJ/mol | 石墨比金刚石稳定 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
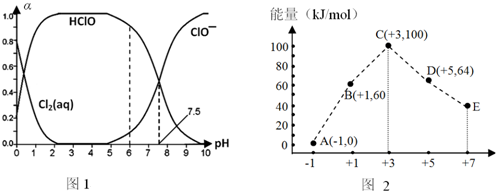
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com