
【题目】以铝土矿主要成分是A12O3,含杂质SiO2、Fe2O3。 工业上从铝土矿中提取铝可采取如下工艺流程:
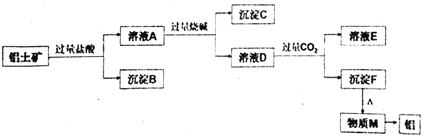
请回答下列问题:
(1)写出铝土矿溶解于过量盐酸的离子方程式___________________________________。
(2)写出溶液A中加过量烧碱的离子方程式___________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为 ____________________________________。
【答案】 Fe2O3+6H+=2Fe3++3H2O、Al2O3+6H+=2A13++3H2O Fe3++3OH-=Fe(OH)3↓ 、Al3++4OH-= AlO2-+2H2O AlO2-+CO2+2H2O=Al (OH) 3↓+HCO3-
【解析】Al2O3、SiO2、Fe2O3中,Al2O3、SiO2与NaOH溶液反应,Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3均与盐酸反应;加入过量盐酸,溶液A为AlCl3、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al。
(1)铝土矿溶解于过量盐酸时,Al2O3、Fe2O3均与盐酸反应;反应的离子方程式为Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;
(2)溶液A为AlCl3、FeCl3,与过量的氢氧化钠反应生成偏铝酸钠和氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓ 、Al3++4OH-= AlO2-+2H2O,故答案为:Fe3++3OH-=Fe(OH)3↓ 、Al3++4OH-= AlO2-+2H2O;
(3)D含有NaAlO2,通入过量二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 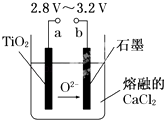
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼丹是古人为追求长生而炼制丹药的方术。晋人葛洪《抱朴子·金丹篇》记载:“凡草木烧之即烬,而丹砂(硫化汞)烧之成水银,积变又还成丹砂”。其中未涉及到的反应类型
A. 化合反应B. 分解反应C. 氧化还原反应D. 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物. 请回答下列问题:;
(1)B的原子结构示意图;
(2)C、D、E三种原子对应的离子半径由大到小的顺序是(填具体离子);由A、B、C三种元素按4:2:3组成的化合物所含的化学键类型属于 .
(3)在100mL18mol/L的浓的A、C、E 组成酸溶液中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是;(填序号) a.7.32L b.6.72L c.20.16L d.30.24L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能将(NH4)2SO4、K2SO4、NH4Cl、KCl四种溶液鉴别开的试剂是
A.NaOH溶液 B.Ba(OH)2溶液 C.BaCl2溶液 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
(3)D是由两种元素组成的三原子分子,电子式是
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
(5)E+F→C+D写出该方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为____ |
(2)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为_____ |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | (3)用结构简式表示A中含有的官能团:___________________________ |
(4)A的核磁共振氢谱如图:
| (4)A中含有____种氢原子 |
(5)综上所述,A的结构简式为______,请写出A与NaHCO3反应的化学方程式______ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C3H8O2 B. CH4 C. C2H5OH D. C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com