
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol/L MgCl2溶液中Cl-的数目为NA
B.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA
C.常温常压下,22.4 L NO和N2的混合气体中分子数目大于NA
D.标准状况下,0.5 mol氦气含有的电子数为NA
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
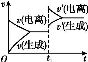
A.加少量烧碱溶液 B.升高温度
C.加少量冰醋酸 D.加水
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学与社会、科学、技术、环境密切相关。下列说法不正确的是( )
A.预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品
B.《添加剂标准》中儿童膨化食品拟禁含铝添加剂,铝对人体有毒害
C.我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限值
D.明矾、硫酸铁等在水中因水解生成胶体粒子,都可用作净水剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
依据元素周期表及元素周期律,下列推断正确的是( )
A.同周期主族元素的原子形成的简单离子电子层结构相同
B.C比Si的原子半径小,CH4的稳定性比SiH4弱
C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱
D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,若等质量的H2O和D2O分别与一定质量的金属钾完全反应,转移的电子数均为 NA,则下列各量不相等的是( )
NA,则下列各量不相等的是( )
A.消耗H2O和D2O的物质的量
B.同温同压下生成气体的体积
C.反应后所得溶液中溶质的质量分数
D.参加反应的钾的质量
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的基态原子的电子排布式是 ;31Ga的第一电离能却明显低于30Zn的,原因是
。
Ⅱ.第4周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一对孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是 。
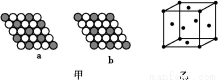
(3)图乙为一个铜晶胞,此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
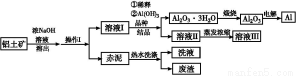
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g)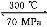 CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
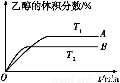
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.升温 B.加压
C.加催化剂D.增加CO2的浓度
(4)现有甲、乙两装置,甲装置为原电池,乙装置为电解池。
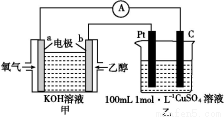
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
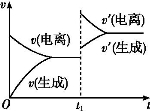
A.加少量烧碱溶液B.升高温度 C.加少量冰醋酸D.加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com