
分析 钠性质活泼,放置在空气中被氧化为氧化钠;在空气中加热反应得到过氧化钠;过氧化钠与水反应生成氢氧化钠和氧气;氯气与NaOH反应生成氯化钠和次氯酸钠和水,
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,漂白粉的有效成分是Ca(ClO)2,次氯酸酸性小于碳酸,根据强酸制取弱酸分析漂白粉长时期露至在空气中失效的原因.
解答 解:钠性质活泼,放置在空气中被氧化为氧化钠,方程式为:4Na+O2═2Na2O;在空气中加热反应得到过氧化钠,方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 ;过氧化钠与水反应生成氢氧化钠和氧气,方程式为:2Na2O2+2H2O═4NaOH+O2↑;氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
次氯酸钙能和酸反应生成次氯酸,次氯酸具有漂白性,所以漂白粉的有效成分是Ca(ClO)2,次氯酸酸性小于碳酸,次氯酸钙和二氧化碳、水反应生成次氯酸,次氯酸不稳定,光照易分解,导致漂白粉失效,反应方程式为Ca(ClO)2+C02+H20=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑,
故答案为:4Na+O2═2Na2O; 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 ;2Na2O2+2H2O═4NaOH+O2↑; Cl2+2NaOH═NaCl+NaClO+H2O;Ca(ClO)2;Ca(ClO)2+C02+H20=2HClO+CaC03↓、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑.
点评 本题考查了元素化合物知识,熟悉钠、氯气的性质是解题关键,注意钠与氧气反应条件对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY3 | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成Cu的物质的量是0.1mol | B. | 随着电解的进行溶液的c(H+)增大 | ||
| C. | 转移电子的物质的量是0.2mol | D. | 阳极反应式是4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 1.2 mol | C. | 2.4 mol | D. | 1.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 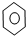 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$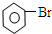 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CO32- | B. | Na+、Fe3+、SO42-、OH- | ||
| C. | Cu2+、Ba2+、Cl-、SO42- | D. | K+、Na+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ①⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与浓溴水反应生成三溴苯酚 | B. | 苯酚能和NaOH溶液反应 | ||
| C. | 苯酚燃烧产生带浓烟的火焰 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com