
【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__.
(2)表中元素原子半径最大的是(写元素符号)__.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为﹣69℃和58℃,写出该反应的热化学方程式:__.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为__,物质的量分别为__,生成硫酸铜物质的量为__.
【答案】 第三周期,第ⅤⅡA族 Si ac Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol NO、NO2 0.9mol、1.3mol 2mol
【解析】根据元素周期表结构可知,X为硅(Si)元素,Y为氧(O)元素,Z为(Cl)元素。
(1)Z为Cl元素,其原子序数为17,原子结构示意图为:![]() ,因此Z位于周期表中第三周期,ⅤⅡA族;
,因此Z位于周期表中第三周期,ⅤⅡA族;
故答案为:第三周期,第ⅤⅡA族;
(2)元素周期表中,同一周期从左向右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大;则原子半径最大的为Si,
故答案为:Si;
(3)比较非金属性的强弱,可以根据元素单质氧化性强弱或氢化物稳定性来比,而与得失电子数目无关。a.Y单质与H2S溶液反应,溶液变浑浊,说明Y单质将H2S氧化为S单质,Y单质的氧化性比硫强,可说明Y元素的非金属性比S元素强,故a正确;b.在氧化还原反应中,得失电子数目与氧化性强弱无关,不能作为非金属性强弱比较的一句,故b错误;c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的氰化物更稳定,Y的非金属性较强,故c正确。
故答案为:ac;
(4)X(Si)与Z(Cl)两元素的单质反应生成1molX的最高价化合物SiCl4,恢复至室温,放热687kJ,又已知该化合物的熔、沸点分别为﹣69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为:Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol。
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol;
(5)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成NO2和NO,相对分子质量都小于50,符合题意。为防止污染,消耗1L 2.2mol/L NaOH 溶液和1mol O2,将生成的气体完全转化为NaNO3。根据N原子守恒,可得n(NaNO3)=n(NO2)+n(NO)=n(NaOH)。铜与酸反应的过程中,铜失去的电子数应等于HNO3所得电子数,还原产物NO2和NO又被O2氧化为NaNO3,N的电子转移至O2,可以理解为铜的电子最后进入O2。故根据原子守恒和电子守恒列式计算。
设NO2的物质的量为x,NO的物质的量为y,
则n(NaNO3)=n(NO2)+n(NO)=n(NaOH)
n(e-) = n(O2)×4=n(NO2)×1+n(NO)×3=n(Cu) ×2
即2.2=x+y,4=x+3y,
解得:x=1.3mol,y=0.9mol。
参与反应的Cu的物质的量为:n(Cu)= 2mol。
故答案为:NO 0.9mol,NO2 1.3mol;2mol。


科目:高中化学 来源: 题型:
【题目】“电解质的溶液中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等,故显电中性,常称电荷守恒”.某盐的溶液中含有Na+、Mg2+、Cl﹣、SO ![]() 四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO
四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO ![]() 物质的量为( )
物质的量为( )
A.0.1mol
B.0.3mol
C.0.5mol
D.0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁和硫反应产物中铁的化合价为+2价或+3价或既有+2也有+3价,某同学设计了如下图所示的实验过程:(已知硫会溶于热碱溶液)
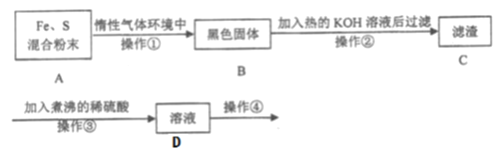
请回答以下问题:
(1)混合粉末A中S粉必须要过量,其原因是为了保证铁粉完全反应,从而避免_____。
(2)反应在“惰性气体环境中”进行的原因是______________________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,这说明了_______。
(4)操作②的作用是________________________________________。
(5)操作③中稀硫酸煮沸的目的是____________________________________。
(6)为探究产物中铁的价态,需要继续对D溶液进行实验,请写出操作④的具体操作、现象及结论:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.请回答下列问题:
(1)阳离子交换膜把电解槽隔成了阴极室和阳极室,电解食盐水时,它只允许__ (填离子符号)通过.
(2)为了去除粗盐中混有的Ca2+、Mg2+、SO42﹣,下列选项中所加试剂(均为溶液)及加入顺序均合理的是__ (填选项字母)
A.先加足量的BaCl2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH,再加入足量的BaCl2,然后加入足量Na2CO3,最后加入适量稀盐酸
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过.

①图中X是__ (填化学式),分析比较图示中a、b、c从大到小的顺序为__.
②写出燃料电池中负极上发生的电极反应式__.
③这样设计的主要节电能之处在于(任写出一条)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用碳及其化合物的性质,完成下列小题:
(1)长期存放石灰水的瓶子内会出现一层白色固体,请分析这层白色固体产生的原因(用化学方程式表示);用完石灰水后,怎样除去瓶壁上的白色固体,(用化学方程式表示).
(2)除去碳酸钠固体中少量碳酸氢钠的方法是(用化学方程式表示):
(3)向碳酸氢钠溶液滴加NaOH溶液,发生反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质,所含原子数目最多的是( )
A.标准状况下,22.4L甲烷
B.标准状况下,44.8L氮气和氧气的混合气体
C.常温常压下,66g二氧化碳气体
D.100mL 1mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40gmL﹣1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0molL﹣1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是
A. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
B. 该浓硝酸中HNO3的物质的量浓度是14.0 molL﹣1
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 该合金中铜与镁的物质的量之比是1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com