
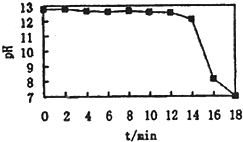
 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:
牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | |
| 步骤2: | |
| 步骤3: | |
| … |
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2:取适量沉淀于试管中,滴加过量稀盐酸 | 若出现无色气泡,则说明含有CaCO3,若无气泡,则说明无CaCO3,而有Al(OH)3. |
| 步骤3:取步骤2的上层清液,滴加氢氧化钠溶液 | 若先生成沉淀,后沉淀溶解说明含有Al(OH)3 若无明显现象,则无Al(OH)3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 钥匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
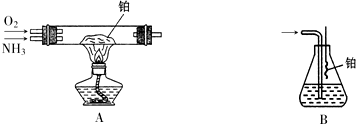
查看答案和解析>>
科目:高中化学 来源: 题型:
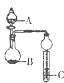
| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com