
 按要求完成下列各小题
按要求完成下列各小题分析 (1)氯化铵溶液中铵根离子是弱碱阳离子,结合水电离出的氢氧根离子促进水的电离,氢离子浓度增大,铵根离子水解显示酸性;
(2)电解质是在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;物质导电的条件:含有自由移动的离子或自由电子;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(4)A.弱电解质不能完全电离;
B.依据盐类水解规律解答;
C.加水稀释能够促进弱电解质电离;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸;
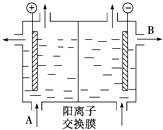
(5)阴离子移向阳极,阳离子移向阴极,图示装置中的交换膜是阳离子交换膜,A出口主要是饱和NaCl溶液,B出口主要是氢氧化钠溶液,装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(6)从结合H+的能力判断:HA+B2-(少量)=A-+HB-,酸性:H2B>HA>HB-;H2B(少量)+2C-=B2-+2HC,酸性:H2B>HB->HC.
解答 解:(1)铵根离子在溶液中水解:NH4++H2O?NH3•H2O+H+,故溶液显酸性,溶液的pH<7,
故答案为:<,NH4++H2O?NH3•H2O+H+;
(2)A.铁是单质,不是电解质,故A错误;
B.盐酸是混合物,不是电解质,故B错误;
C.氯化钠在水溶液里或熔融状态下能导电的化合物,是电解质,但是不含有自由移动的离子或自由电子,不导电,故C错误;
D.熔融氢氧化钠含有自由移动的离子能够导电,是电解质,故D选;
故答案为:D;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH抑制水电离,氯化铵促进水电离,所以C1<C2,故答案为:<;
(4)A.强酸能够完全电离,0.1mol/L HA强酸的pH=1,而若0.1mol/L HA的pH>l,说明HA不能完全电离,故A为弱酸,故A正确;
B.只有强碱弱酸盐才能水解,NaA溶液的pH>7,说明A-发生水解,则HA为弱酸,故B正确;
C.加水稀释,弱酸电离程度增大,氢离子物质的量增加,PH变化小于2,盐酸中氢离子物质的量不变,故盐酸PH变化为2,故盐酸PH变化大,故C正确;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的Zn反应,醋酸产生的氢气比盐酸多,故D错误;
故答案为:D;
(5)①阴离子移向阳极,阳离子移向阴极,图示装置中的交换膜是阳离子交换膜,A出口主要是饱和NaCl溶液,B出口主要是氢氧化钠溶液,
故答案为:饱和NaCl溶液;稀NaOH溶液;
②装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O═Cl2↑+H2↑+2OH-;
(6)从结合H+的能力判断:HA+B2-(少量)=A-+HB-,酸性:H2B>HA>HB-;H2B(少量)+2C-=B2-+2HC,酸性:H2B>HB->HC;
HA+C-=A-+HC,酸性:HA>HC;则有酸性:H2B>HA>HB->HC,盐对应的酸越弱,对应的酸根离子的水解程度越大,当PH相同时,对应的物质的量浓度由大到小的顺序为③>①>②>④,
故答案为:③>①>②>④.
点评 本题考查弱电解质强弱的判断、弱电解质的电离、盐的水解、电解原理的应用等,熟悉弱电解质电离方式及电离平衡移动影响因素、熟悉电解原理及熟悉盐类水解规律是解题关键,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列反应不需要加热就能进行的吸热反应是( )
A.碳酸钙分解
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)2•8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用NaOH已吸潮 | B. | NaOH溶解后立即转移到容量瓶中 | ||
| C. | 有少量NaOH溶液残留在烧杯内 | D. | 向容量瓶加水时眼睛一直仰视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大 | |
| B. | 盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取 | |
| C. | 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 | |
| D. | 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO- | |
| C. | 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5 | |
| D. | 向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
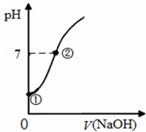 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 | |
| D. | 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com