
| A. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | SO2通入溴水中:SO2+Br2+2H2O═SO42-+2Br-+4H+ | |
| C. | Fe(OH)2溶于过量的稀HNO3:Fe(OH)2+2H+═2Fe2++2H2O | |
| D. | 少量氯水滴入FeBr2溶液中:Cl2+2Br-═2C1-+Br2 |
分析 A、铁和稀硫酸反应生成亚铁离子;
B、二氧化硫和溴水反应生成硫酸和HBr;
C、Fe(OH)2和硝酸反应氧化还原反应;
D、Fe2+的还原性强于Br-,故少量的氯水先和Fe2+反应.
解答 解:A、铁和稀硫酸反应生成亚铁离子和氢气,故离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B、二氧化硫有强还原性,而溴有强氧化性,故二氧化硫和溴水反应生成硫酸和HBr,化学方程式为:SO2+Br2+2H2O═H2SO4+2HBr,故离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+,故B正确;
C、Fe(OH)2有强还原性,而硝酸由强氧化性,故两者发生氧化还原反应生成硝酸铁、NO和水,化学方程式为:3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+5H2O,离子方程式为:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+5H2O,故C错误;
D、由于Fe2+的还原性强于Br-,故少量的氯水先和Fe2+反应生成氯离子和铁离子,故离子方程式为Cl2+2Fe2+═2C1-+2Fe3+,故D错误.
故选B.
点评 本题考查了离子方程式书写的正误判断,应注意先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,还要除以反应原理是否正确.难度适中.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中有三聚氟化氢(HF)3分子存在 | |
| B. | 冰的密度比液态水的密度小 | |
| C. | H2O的分解温度比H2S高 | |
| D. | 乙醇能与水以任意比混溶而甲醚(CH3-O-CH3)难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中微粒间可能存在氢键 | |
| D. | C3N4晶体是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 |  | 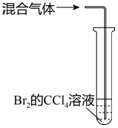 |  |  |
| 目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内气体的密度不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为2:1 | |
| D. | 混合气体的质量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com