
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强。
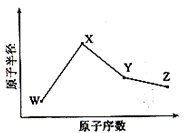
(1) 写出X在周期表中的位置 。
(2)W的简单离子的还原性比Y简单离子的还原性 (填强或弱);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与W形成的化合物和Z单质水溶液反应,生成二种强酸,该反应的化学方程式是 。
(4)已知25℃时,2.3gC2H5OH(l)在足量的W单质充分反应后恢复原状,放出68.34kJ热量, 则该反应的热化学方程式:
 (5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
(5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
 ①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强 B.氢氧化钡的碱性比氢氧化钙的碱性强
C.硒化氢比硫化氢稳定 D.若Xm+ 和Yn- 核外电子层结构相同,则在周期表中X、Y的族序数之差一定为:(m+n)-8
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铅蓄电池Pb + PbO2 + 2H2SO4 ==2PbSO4 + 2H2O 在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。下列说法中正确的是
A.标有“+”的接线柱,充电时作阳极,放电时作负极
B.放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少
C.充电时电路中通过0.1mol电子时,电解质溶液有0.2molH2SO4 产生
D.充电时阳极中PbSO4 被还原为PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
对于:2C4H10(g) + 13O2(g) = 8CO2(g) + 10H2O(l) △H=-5800kJ/mol 叙述错误的是( )
A.该反应的反应热为△H= -5800kJ/mol,是放热反应。
B.该反应的△H与各物质的状态有关,与化学计量数也有关。
C.该式的含义为:25℃、101kPa,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ。
D.由该反应的热化学方程式可知丁烷的燃烧热为5800kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色
的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理
有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com