
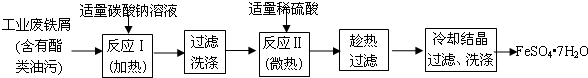
分析 废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,升高温度促进CO32-水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,发生反应II为Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO4•7H2O.
(1)废铁中含氧化铁,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁;
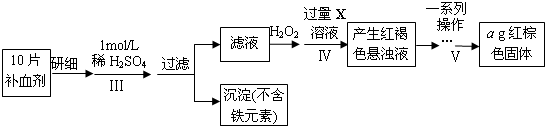
将补血剂研细,向药片中加入稀硫酸,然后过滤得到沉淀,向滤液中加入双氧水,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入过量X溶液生成红褐色沉淀,则X为碱,将红褐色沉淀灼烧得到红棕色固体Fe2O3.
(2)配制一定物质的量浓度溶液用到的玻璃仪器有烧杯、玻璃棒、量筒、容量瓶以及胶头滴管等;
(3)步骤Ⅴ由氢氧化铁灼烧成氧化铁,经过一系列操作依次是:①过滤②洗涤③灼烧④冷却⑤称量⑥恒重操作,操作⑥的目的是确保氢氧化铁完全分解成了氧化铁;
(4)根据铁原子守恒计算.
解答 解:(1)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;
(2)根据配制一定物质的量浓度的硫酸溶液的步骤可知,配制过程中使用的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管等,所以还需要100mL容量瓶,
故答案为:100mL容量瓶;
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③灼烧④冷却⑤称量⑥恒重操作,操作⑥的目的是确保氢氧化铁完全分解成了氧化铁,保证得到纯净的氧化铁,
故答案为:灼烧;保证得到纯净的氧化铁;
(5)ag中m(Fe)=$\frac{112}{160}$×ag=0.7ag,则每片药品中Fe的质量为0.07ag,
故答案为:0.07a.
点评 本题考查物质的分离和提纯、物质含量的测定,侧重考查分析、计算、基本操作能力,明确每一步发生的反应是解本题关键,知道物质分离和提纯的基本方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  检验溶液中是否含有K+ | B. |  除去水中的乙醇 | ||
| C. | 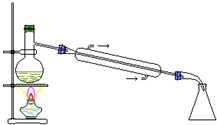 分离乙酸和乙酸钠 | D. | 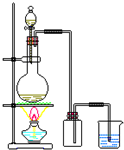 用MnO2和浓盐酸制备Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g重水(D2O)中含有的质子数和中子数均为NA | |
| B. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 10 mol•L-1的浓硝酸与足量铜加热反应转移电子数为0.2NA | |
| B. | 标准状况下,11.2L氦气中含有NA原子 | |
| C. | 在精炼铜或电镀铜的过程中,当阳极消耗铜32g时,转移电子数均为NA | |
| D. | 标准状况下,2.24L Cl2通入足量NaOH溶液中发生反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、Na+、HCO3-、K+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Al3+、Cl-、CO32- | D. | Cu2+、NH4+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com