
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
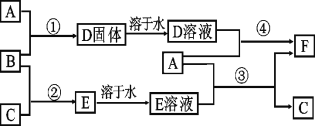
请回答:
(1)写出B物质的化学式:_______;F的化学名称:_______。
(2)写出第②步C在B中燃烧的反应现象:_______。
(3)写出第④步反应的化学反应方程式_______。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____,写出该反应的化学方程式_____________________ 。
【答案】Cl2 氯化亚铁 产生苍白色火焰,瓶口有白雾产生 Fe+2FeCl 3=3FeCl2 先产生白色沉淀,后立即变成灰绿色,最后变成红褐色 4Fe(OH)2+2 H2O + O2 =4Fe(OH)3
【解析】
B、C是气体单质,B、C反应生成E,E溶液为常见强酸,所以E溶液是盐酸;A是用途最广的金属,D溶液中滴加KSCN溶液显血红色,A是铁,铁与盐酸反应生成氯化亚铁和氢气,则C是氢气、B是氯气,D是氯化铁,F是氯化亚铁。
根据以上分析,(1)B是氯气,化学式是Cl2;F是氯化亚铁。
(2)C是氢气、B是氯气,氢气在氯气中燃烧的反应现象是产生苍白色火焰,瓶口有白雾产生。
(3)第④步反应是氯化铁和铁反应,反应的化学反应方程式是Fe+2FeCl 3=3FeCl2。
(4)氯化亚铁溶液中滴入NaOH溶液,生成白色氢氧化亚铁沉淀,氢氧化亚铁被氧气氧化为红褐色氢氧化铁,可能产生的实验现象是先产生白色沉淀,后立即变成灰绿色,最后变成红褐色,反应的化学方程式是4Fe(OH)2+2 H2O + O2 =4Fe(OH)3。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟![]() 可以发生反应:
可以发生反应:![]() ,关于该反应下列说法中不正确的是()
,关于该反应下列说法中不正确的是()
A.![]() 既不是氧化产物也不是还原产物
既不是氧化产物也不是还原产物
B.该反应中被氧化和被还原的氮元素的质量比是2:3
C.若有![]() 完全反应,共转移12mol电子
完全反应,共转移12mol电子
D.NO是氧化剂,![]() 是还原剂
是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
A. 乙烯在一定条件下能发生加成反应,加聚反应,被酸性高锰酸钾溶液氧化
B. 符合分子式为C3H8O的醇有三种不同结构
C. 如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷![]()
D. 治疗疟疾的青蒿素(如图)易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
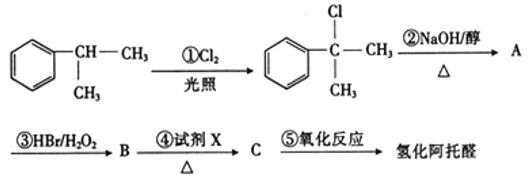
【题目】氢化阿托醛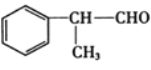 是一种重要的化工原料,其合成路线如图:
是一种重要的化工原料,其合成路线如图:
已知:HBr+CH3-CH=CH2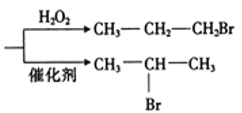
请根据上述合成路线,回答下列问题:
(1)一定条件下,1 mol氢化阿托醛最多可跟___mol氢气加成。
(2)②的反应类型是_______。写出它的化学方程式:______。
(3)④中所用试剂X为_______。
(4)写出反应⑤的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物a和苯反应生成有机物b。下列分析正确的是
![]() + HCl
+ HCl
A.该反应是加成反应
B.若R为CH3,b中所有原子可能共面
C.若R为CH3,b的一氯代物共有3种
D.若R为C4H9,b可能的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺(NH2Cl,Cl的化合价为+1价)是一种长效缓释有机氯消毒剂,它与水可以发生复分解反应。有关氯胺的说法错误的是
A.氯胺中的氮元素为-3价
B.氯胺与水反应的产物为NH2OH和HCl
C.氯胺的消毒原理与漂粉精相似
D.氯胺的消毒效率(单位质量的消毒剂得到的电子数)是Cl2的1.38倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备合成氨原料气过程中存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
A. 该反应的逆反应是放热反应B. 反应物总能量小于生成物总能量
C. 反应中生成22.4LH2(g),放出41kJ热量D. 反应中消耗1mol CO(g),放出41kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
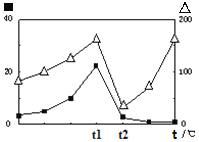 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com