
分析 (1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水;
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,正极上氧气得电子和水反应生成氢氧根离子;根据电池反应式中KOH和转移电子之间的关系式计算;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等.
解答 解:(1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,正极反应为O2+4H++4eˉ=2H2O、负极反应为2H2-4eˉ=4H+,故答案为:O2+4H++4eˉ=2H2O;2H2-4eˉ=4H+;
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,电极反应为CH4+10OH--8e-=CO32-+7H2O;电池反应式为CH4+2KOH+2O2=K2CO3+3H2O,根据KOH和转移电子之间的关系式得消耗n(KOH)=$\frac{8mol}{8}×2$=2mol;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等,生成等物质的量的四种氯代物,则生成四种氯代物的物质的量都是1mol,消耗氯气的物质的量=1mol×(1+2+3+4)=10mol,
故答案为:CH4+10OH--8e-=CO32-+7H2O;2;10.
点评 本题考查了原电池原理及物质的量的计算,根据溶液酸碱性书写电极反应式,注意烷烃发生取代反应时被取代氢原子与氯气的物质的量之比,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
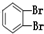
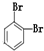 ⑪
⑪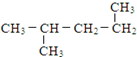 ⑫
⑫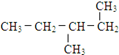
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
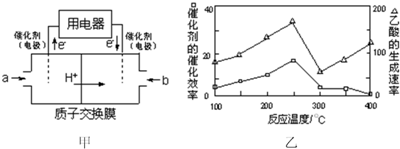
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g18O2中含有NA个氧原子 | |
| B. | 在氮原子中,质子数为7而中子数不一定为7 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | Cl-的结构示意图为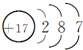 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
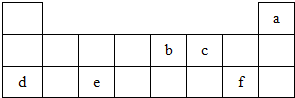
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com