
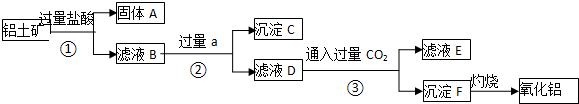
分析 由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,分解可生成氧化铝,滤液E中含有NaCl、NaHCO3,以此解答该题.
解答 解:由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,分解可生成氧化铝,滤液E中含有NaCl、NaHCO3,
(1)由以上分析可知A为SiO2,C为Fe(OH)3,F为Al(OH)3,a为NaOH,故答案为:SiO2;Fe(OH)3;Al(OH)3;NaOH;
(2)反应①后的产物为固体和液体,可用过滤的方法分离,可用KSCN溶液检验铁离子,二者反应,溶液变为血红色,
故答案为:过滤;KSCN溶液(或硫氰化钾溶液); 溶液显血红色;
(3)氯化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(4)氢氧化铝为两性氧化物,可与盐酸反应生成氯化铝,制备氢氧化铝,应用偏铝酸钠与二氧化碳反应,不能用盐酸,
故答案为:不能;A1(OH)3沉淀会溶于过量的盐酸中.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
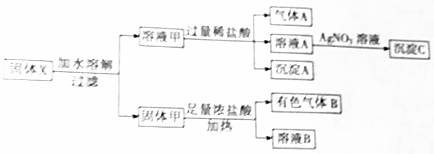
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.
小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
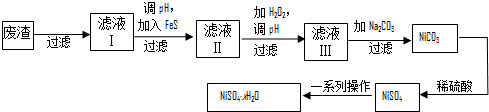
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
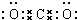 .
.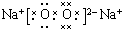 ,其存在的化学键是离子键和非极性键
,其存在的化学键是离子键和非极性键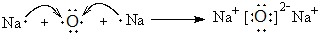 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
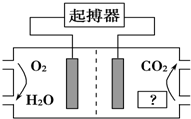 如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )
如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )| A. | 图中“?”为人体中的脂肪 | |
| B. | O2极为心脏起搏器的负极 | |
| C. | 产生的CO2使人体血液呈酸性,长期使用对人体有害 | |
| D. | 电池正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
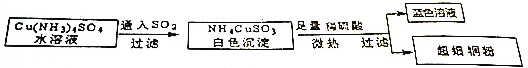
| A. | SO2在此过程中作氧化剂 | |
| B. | 超细铜粉能导电,所以超细铜粉是电解质 | |
| C. | 工业上常用电解法冶炼铜 | |
| D. | 理论上制得1mol铜粉,共转移3mole- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com