
���� ��1��SO2Cl2��g��+SCl₂��g��?2SOCl2��g�� ���ɣ���������ӵõ�����ƽ�ⳣ��Ϊ����֮������Ӧ��Ϊ����֮�ͣ�
��2��13.5g SO2Cl2�����ʵ���Ϊ$\frac{13.5g}{135g/mol}$=0.1mol��10min�ﵽƽ��ʱSO2Cl2ת����Ϊ0.80����ת����SO2Cl2Ϊ0.080mol����
SO2Cl2��g��?SO2��g��+Cl2��g��
��ʼ����mol����0.1 0 0
�仯����mol����0.08 0.08 0.08
ƽ������mol����0.02 0.08 0.08
�ٸ���v=$\frac{��c}{��t}$����v��Cl2����
����ƽ��ʱ������������ʵ�����ѹǿ֮�ȵ������ʵ���֮�ȣ�
ƽ�ⳣ��K=$\frac{c��S{O}_{2}����c��C{l}_{2}��}{c��S{O}_{2}C{l}_{2}��}$��
��Ҫ��Сת���ʣ���ͨ����С��������������ѹǿ�ķ�����Ҳ����ʼʱ��������ͬʱ����SO2Cl2��Cl2��SO2�ȣ�
��3��SO2Cl2����Ϊ+6�ۣ���Ϊ-1��������������ʱ���������ƺ��Ȼ��ƣ�SOCl2����Ϊ+4�ۣ�ˮ������SO2��HCl��
��4��������Ӧ��Cl2+2NaOH=NaCl+NaClO+H2O����Ȼc��Na+������ǵ�ClO-ˮ���Լ��ԣ���c��Cl-����c��ClO-����c��OH-����c��H+����HClO�ĵ��볣����ClO-ˮ�ⷴӦ��ƽ�ⳣ��֮������ˮ�����ӻ���
��� �⣺��1��SO2Cl2��g��+SCl₂��g��?2SOCl2��g�� ���ɣ���������ӵõ�����ƽ�ⳣ��Ϊ����֮������Ӧ��Ϊ����֮�ͣ���K=K1•K2���÷�Ӧ��H=��a+b��kJ/mol��
�ʴ�Ϊ��K1•K2����a+b����
��2��13.5g SO2Cl2�����ʵ���Ϊ$\frac{13.5g}{135g/mol}$=0.1mol��10min�ﵽƽ��ʱSO2Cl2ת����Ϊ0.80����ת����SO2Cl2Ϊ0.080mol����
SO2Cl2��g��?SO2��g��+Cl2��g��
��ʼ����mol����0.1 0 0
�仯����mol����0.08 0.08 0.08
ƽ������mol����0.02 0.08 0.08
v��Cl2��=$\frac{\frac{0.08mol}{2L}}{10min}$=0.004mol•L-1•min-1��
ƽ��ʱ�����ʵ���Ϊ��0.02mol+0.08mol+0.08mol=0.18mol����ƽ��ʱѹǿΪ��$\frac{0.18mol}{0.1mol}$��101kPa=181.8kPa��
���¶���ƽ�ⳣ��K=$\frac{c��S{O}_{2}����c��C{l}_{2}��}{c��S{O}_{2}C{l}_{2}��}$=$\frac{\frac{0.08mol}{2L}��\frac{0.08mol}{2L}}{\frac{0.02mol}{2L}}$=0.16mol•L-1��
��Ҫ��Сת���ʣ���ͨ����С��������������ѹǿ�ķ�����Ҳ����ʼʱ��������ͬʱ����SO2Cl2��Cl2��SO2�ȣ�
�ʴ�Ϊ��0.004mol•L-1•min-1��181.8��0.16mol•L-1������ѹǿ������С�����������
��3��SO2Cl2����Ϊ+6�ۣ���Ϊ-1��������������ʱ���������ƺ��Ȼ��ƣ���Ӧ����ʽΪ��SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O��
SOCl2����Ϊ+4�ۣ�ˮ������SO2��HCl����Ӧ���ӷ���ʽΪ��SOCl2+H2O=SO2��+2H++2Cl-��
�ʴ�Ϊ��SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O��SOCl2+H2O=SO2��+2H++2Cl-��
��4��������Ӧ��Cl2+2NaOH=NaCl+NaClO+H2O����Ȼc��Na+������ǵ�ClO-ˮ���Լ��ԣ���c��Cl-����c��ClO-����c��OH-����c��H+��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��c��Na+����c��Cl-����c��ClO-����c��OH-����c��H+����
HClO�ĵ��볣����ClO-ˮ�ⷴӦ��ƽ�ⳣ��֮������ˮ�����ӻ�����NaClOˮ�ⷴӦ��ƽ�ⳣ��Kb=$\frac{1{0}^{-14}}{2.5��1{0}^{-8}}$=4��10-7��
�ʴ�Ϊ��c��Na+����c��Cl-����c��ClO-����c��OH-����c��H+����4��10-7��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ������Ӧ�ȼ��㡢����Ũ�ȴ�С�Ƚϵȣ���Ҫѧ���߱�֪ʶ�Ļ�������������������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �û���Ӧ | C�� | �ֽⷴӦ | D�� | ���ֽⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ʵ������ijʵ��С��ͬѧ��������ͭ����ȡ��Ӧ�ã����������ʵ�飺
��ʵ������ijʵ��С��ͬѧ��������ͭ����ȡ��Ӧ�ã����������ʵ�飺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
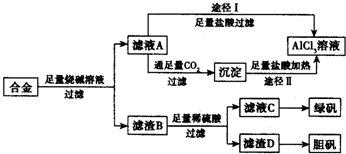 ��ҵ���ú�����������ͭ�ĺϽ�ҵ������ȡ�������Ȼ�����Һ���̷����壨FeSO4•7H2O�� �͵������壨CuSO4•5H2O����������·�����ͼ��ʾ����ش�������⣺
��ҵ���ú�����������ͭ�ĺϽ�ҵ������ȡ�������Ȼ�����Һ���̷����壨FeSO4•7H2O�� �͵������壨CuSO4•5H2O����������·�����ͼ��ʾ����ش�������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
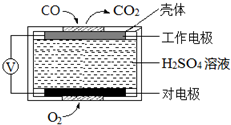 ̼��������������������Ĵ�������������������о����ȵ����⣮
̼��������������������Ĵ�������������������о����ȵ����⣮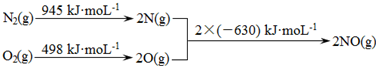
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������̼���������ЧӦ����Ҫ���壬������̼�Ļ����������Ǽ�������ЧӦ����Ч;��֮һ��
������̼���������ЧӦ����Ҫ���壬������̼�Ļ����������Ǽ�������ЧӦ����Ч;��֮һ��| �¶�/K CO2ת����/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�¶�ʱ����VL�ܱ������У�A��B��C�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ�����
ij�¶�ʱ����VL�ܱ������У�A��B��C�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
 ��1.0L�����ܱ�������Ͷ��1mol CO2��2.75mol H2������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ�״������ʵ����仯��ͼ��ʾ������˵������ȷ���ǣ�������
��1.0L�����ܱ�������Ͷ��1mol CO2��2.75mol H2������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ�״������ʵ����仯��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | �÷�Ӧ������ӦΪ���ȷ�Ӧ | |
| B�� | ѹǿ��С��ϵΪp1��p2��p3 | |
| C�� | M���Ӧ��ƽ�ⳣ��K��ֵԼΪ1.04��10-2 | |
| D�� | ��p2��512Kʱ��ͼ��N��v��������v���棩 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com