
| A. | Na+、Ba2+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、HCO3- | D. | Al3+、K+、SO42-、Cl- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
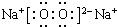 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.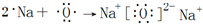 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 在金属元素和非金属元素分界线,可以找到半导体材料 | |
| C. | 元素周期表有十六个族,也就有十六个纵行 | |
| D. | 元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com