
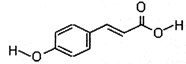
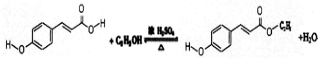
 .
. 分析 (1)由结构简式可知分子式,含酚-OH、碳碳双键、-COOH;
(2)结合酚、烯烃、羧酸的性质来解答;
(3)能与氢气发生反应的为苯环和碳碳双键,能与溴发生的为酚羟基的邻位的取代反应和碳碳双键的加成反应;
(4)含有羧基,可与乙醇在浓硫酸作用下发生酯化反应.
解答 解:(1)由结构简式可知分子式为C9H8O3,含氧官能团酚-OH、-COOH,名称分别为(酚)羟基、羧基,故答案为:C9H8O3;(酚)羟基、羧基;
(2)A.含-OH、碳碳双键,可发生氧化反应,故A正确;
B.不能发生消去反应,故B错误;
C.含碳碳双键,可发生加聚反应,故C正确;
D.不含能水解的官能团,不能发生水解反应,故D错误;
故答案为:AC;
(3)能与氢气发生反应的为苯环和碳碳双键,共需4mol氢气,能与溴发生的为酚羟基的邻位的取代反应和碳碳双键的加成反应,共需要3mol溴,
故答案为:4;3;
(4)含有羧基,可与乙醇在浓硫酸作用下发生酯化反应,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、烯烃性质的考查,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 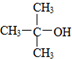 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 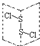 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是复分解反应 | |
| B. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | 生成2 mol ClO2时转移的电子数为6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com