
| 族 周期 | ⅠA | 0 | ||||||
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He | ||
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
分析 根据元素在周期表中位置可知,A、B、C、D、E、F、G、H、I、J、K、L分别为:H、Li、O、F、Na、Mg、Al、Si、P、S、Cl、Ar元素.
(1)G为铝元素,元素周期表右上角元素F非金属性最强;
(2)A、元素的金属性越强,其对应最高价氧化物的水化物的碱性越强;
B、元素的非金属性越强,其获得电子能力越强;
C、元素的非金属性越强,其对应氢化物越稳定;
D、同一周期,原子序数越小,半径越大.
解答 解:根据元素在周期表中位置可知,A、B、C、D、E、F、G、H、I、J、K、L分别为:H、Li、O、F、Na、Mg、Al、Si、P、S、Cl、Ar元素.
(1)G为铝元素,元素周期表右上角元素F非金属性最强,最容易获得电子,名称为氟,故答案为:Al;氟;
(2)A、氢氧化物的碱性同周期从左到右,碱性减弱,故A错误;
B.同周期从左到右,非金属性增强,获得电子能力增强,故B错误;
C.同主族从上到下,气态氢化物稳定性减弱,故C正确;
D.同周期,从左到右原子半径依次减小,故D错误;
故答案为:C.
点评 本题考查元素周期表与元素周期律的关系,题目难度不大,注意元素周期律的递变规律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
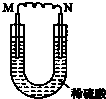
| A. | M上有气体放出 | |
| B. | M为负极,N为正极 | |
| C. | 化学能转变为电能的装置 | |
| D. | 导线中有电流通过,电流方向由N到M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
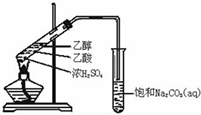 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.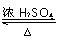 CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 新合成的一种烃,其碳架呈三棱柱体(如图所示)
新合成的一种烃,其碳架呈三棱柱体(如图所示)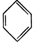 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

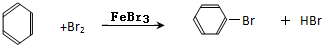 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com