
下列各组物质中都属于极性分子的一组是( )
A.HF、NH3、O3 B.NO、SO2、CCl4
C.SO3、H2O、N2 D.CO、BF3、CS2
科目:高中化学 来源: 题型:
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:


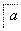

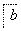 ,③
,③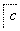 ,④
,④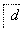 电解,
电解,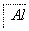
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期;B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子,试回答下列问题:
(1)写出五种元素的名称:
A__________,B__________,C__________,
D__________,E__________。
(2)写出A、B形成的AB型离子化合物与CO2反应的化学方程式。
(3)写出D元素形成的单质的结构式
(4)C、E元素形成化合物的空间构型为。
查看答案和解析>>
科目:高中化学 来源: 题型:
处于前三周期的主族元素A、B、C、D,其离子半径逐渐增大,它们的原子中核外都有一个未成对电子。已知A和D处于同一周期,0.2 mol A单质可以从D的氢化物的水溶液中置换出6.72 L H2(标准状况),试回答:
(1)写出元素符号:
A.________,B.________,C.________,D.________;
(2)若C有气态氢化物存在,比较C和D的氢化物:
沸点__________,稳定性__________,水溶液的酸性____________;
(3)四种元素的第一电离能由大到小的排列顺序是________________________;
(4)四种元素的电负性由小到大的顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、“偏低”或“不变”)。
(2)氨气常用________检验,现象是______________________________________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
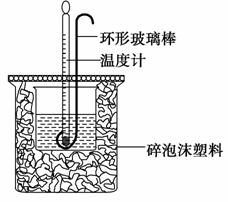
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是________________________________________________________________
_______________________________________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_______________________________________________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com