
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 镀锌铁镀层破损后,铁更容易被腐蚀 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
分析 A.硫酸钡溶于水的部分完全电离,属于强电解质;
B.锌的活泼性大于铁,镀层破损后,二者形成原电池,锌容易被腐蚀;
C.白色污染的主要成因为塑料制品;
D.推广使用新能源,可以减少化石燃料的利用,有利于缓解温室效应.
解答 解:A.硫酸钡溶于水的部分或熔融状态下完全电离,是强电解质,故A错误;
B.镀锌铁镀层破损后,锌做负极,故铁受保护,故B错误;
C.白色污染是指塑料污染,故C正确;
D.推广使用太阳能、风能、海洋能、氢能,减少碳的排放,有利于缓解温室效应,故D错误;
故选C.
点评 本题考查了弱电解质的判断、金属的电化学腐蚀、常见的生活污染等知识,题目难度中等,注意明确强弱电解质的区别,掌握电化学腐蚀原理、常见生活污染及治理方法.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3溶解度较大 | B. | KHCO3溶解度较小 | C. | K2CO3溶解度较大 | D. | K2CO3溶解度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷 | B. | CHCl3 | C. | 苯酚 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
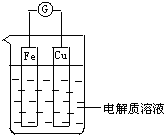 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA | |
| B. | 1mol甲基含有的电子数为10NA | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1NA | |
| D. | 标准状况下,4.48L CHCl3中分子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com