
| A. | CaCl2 | B. | NaOH | C. | H2O | D. | Na2O |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| A. | 在pH=5的溶液中.Fe3+不能大量存在 | |
| B. | 混合溶液中c(SO42-):[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5:4 | |
| C. | 向混合溶液中逐滴加入0.1mol•L-1NaOH溶液,最先看到红褐色沉淀 | |
| D. | 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 溴苯(溴) | 氢氧化钠 | 分液 |
| B | 乙烷(乙烯) | 氢气 | 催化剂、加热 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠 | 分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
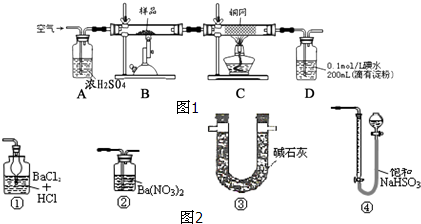
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中由电能转化为化学能 | B. | 原电池中失电子的电极作负极 | ||
| C. | 原电池的负极发生还原反应 | D. | 原电池中电子由正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C+CO2═2CO是吸热反应,当温度升高时,v正增大,v逆减少 | |
| B. | 两个非金属原子之间形成的化学键一定是共价键 | |
| C. | 含有离子键的物质不可能是单质 | |
| D. | 单质中不一定含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com