
 .
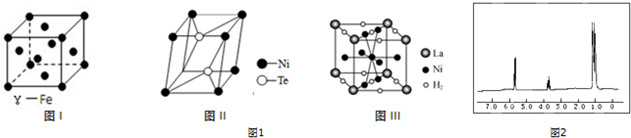
.

分析 (1)①Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;
②利用价层电子对互斥模型判断;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②根据中心原子形成的δ键和孤电子对数判断杂化类型;
③据CO2的结构式O=C=O判断;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(4)①根据晶胞结构图可知,以顶点上的铁原子为例,距离最近且相等的铁原子位于经过该顶点的12个面的面心上,据此答题;
②利用均摊法确定其化学式;
③根据均摊法,可计算出1mol La的合金可吸附H2的数目;
(5)核磁共振谱中的峰面积比分别为1:1:6,说明该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6.
解答 解:(1)①Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),故答案为:1s22s22p63s23p63d5(或[Ar]3d5);
②NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(2)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;
②H2O 分子中O形成2个δ键,孤电子对数为$\frac{6-2×1}{2}$=2,则为杂化sp3;
③CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键数目为×6.02×1023个(或2mol),
故答案为:2×6.02×1023个(或2mol);
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: ;
;
(4)①根据晶胞结构图可知,以顶点上的铁原子为例,距离最近且相等的铁原子位于经过该顶点的12个面的面心上,所以每个铁原子周围距离最近且相等的铁原子数目为12,
故答案为:12;
②该晶胞中镍原子个数=8×$\frac{1}{8}$,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2,
故答案为:NiTe2;
③根据均摊法,可知每个晶胞中含有La原子为8×$\frac{1}{8}$=1,而每个晶胞中含有氢分子的个数为:8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,所以1mol La的合金可吸附H2的数目为3mol,
故答案为:3 mol或3NA;
(5)根据该有机物的核磁共振谱中的峰面积比分别为1:1:6可知:该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6,1-丙醇(CH3-CH2-CH2-OH}中不同位置的氢原子有三种,其数目之比为1:3:4;
2-丙醇 中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2-丙醇,
中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2-丙醇,
故答案为:2-丙醇.
点评 本题考查了物质结构和性质,涉及化学键、晶体的计算、核外电子排布式的应用等知识点,这些知识点都是高考热点,学会根据均摊法确定物质的化学式,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和AgCl、AgBr的混合溶液中c(Cl-)/c(Br-)=360 | |
| B. | 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 向含有AgCl的饱和溶液中加入少量水后,c(Cl-)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓硫酸 | B. | KMnO4酸性溶液、浓硫酸 | ||
| C. | 溴水、浓硫酸 | D. | 浓硫酸、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com