
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖  的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的  最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
分析 A、取代基的位次不是最小;
B、烷烃沸点规律:分子中碳数越多,沸点越高;对于含碳数相同的烷烃而言,支链越多,沸点越低;
C、根据结构式书写化学式,环上没有标注元素符合的交点为碳原子,肌醇属于醇,不属于糖类;
D、酚-OH、-COOC能与NaOH溶液反应.
解答 解:A、取代基的位次不是最小,应是为2,3,6-三甲基-4-乙基庚烷,故A错误;
B、正戊烷、异戊烷、新戊烷互为同分异构体,支链越多,沸点越低,故三者沸点依次降低,故B错误;
C、二者化学式均为C6H12O6,满足Cm(H2O)n,肌醇属于醇,不属于糖类,葡萄糖属于糖类,选项中结葡萄糖为吡喃式构形,故C错误;
D、分子中含有1个酚羟基、3个酯基,都能与NaOH反应,其中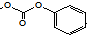 能和3molNaOH反应,则1mol该有机物最多能和含5molNaOH的水溶液完全反应,故D正确;
能和3molNaOH反应,则1mol该有机物最多能和含5molNaOH的水溶液完全反应,故D正确;
故选D.
点评 本题考查烷烃的命名、有机物结构与性质、官能团性质等,难度中等,D为易错点,容易忽略右边的酯基水解会生成苯酚.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | pH=2.2时,溶液中主要含铁形体浓度的大小关系为c(H3FeO4+)>c(HFeO4-) | |
| B. | 为获得尽可能纯净的高铁酸盐,pH应控制pH≥9 | |
| C. | 常温时,NaHFeO4水溶液显碱性 | |
| D. | 向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-═FeO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
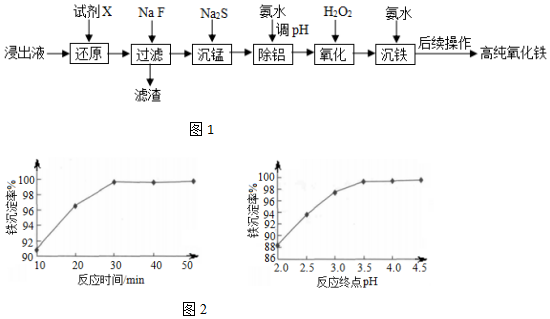
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gCu在足量O2或硫蒸气中完全燃烧失去的电子数均为NA | |
| B. | 4g甲烷和8g甲醇含有的氢原子数均为NA | |
| C. | 标准状况下,5.6L乙烷中含有的共价键数目为1.5NA | |
| D. | 一定条件下,32gSO2与足量O2反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中存在Na+、不含K+ |
| B | 用浓盐酸和石灰石反应声生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 将石蜡油在碎瓷片上加热,产生的气体通过酸性KMnO4溶液 | 酸性KMnO4溶液紫红色褪去 | 石蜡油分解产生了不同于烷烃的气体,且该气体具有还原性 |
| D | 某溶液加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42-或者Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
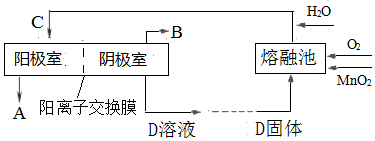
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室用如图装置来制取NH3 | B. | 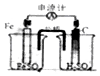 实验如图碳棒上有无色气泡产生 | ||
| C. | 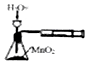 实验如图定量测定H2O2的分解速率 | D. |  实验如图检验钾元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com