
 实验室用下列方法测定某水样中O2的含量
实验室用下列方法测定某水样中O2的含量2- 3 |
| 1 |
| 4 |
| 1000 |
| 20 |


科目:高中化学 来源: 题型:
| A、①② | B、④① | C、②③ | D、③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N、O、S |
| B、Cl、N、P |
| C、Be、F、Cl |
| D、F、N、P |
查看答案和解析>>
科目:高中化学 来源: 题型:
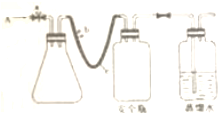
 用如图所示的装置进行实验:
用如图所示的装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示第三周期元素原子半径的变化规律 表示第三周期元素原子半径的变化规律 |
B、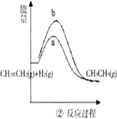 a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0在使用和未使用催化剂时,反应过程中的能量变化 |
C、 实验用于测定稀盐酸的浓度 |
D、 实验可用于验证HCl在水中的溶解性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3是碱性气体,能使酚酞溶液变红色 |
| B、SiO2是酸性氧化物,不溶于任何酸 |
| C、SO2具有漂白性,能使溴水褪色 |
| D、浓H2SO4具有吸水性,能使蔗糖发生炭化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com