
| A、使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ |
| B、澄清透明的溶液中:ClO-、MnO4-、Al3+、SO42- |
| C、澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ |
| D、水电离产生c(H+)=1×10-12mol/L的溶液中,Mg2+、Na+、Cl-、HCO3- |


科目:高中化学 来源: 题型:
| 元素代号 | Q | R | X | Z | ||
| 微粒信息 | 离子: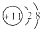 | 单质分子:R2 | 离子:X3+ | 一种原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠的活泼性比铜的强,所以钠可和硫酸铜溶液反应生成铜 |
| B、氢氧化铝是两性氢氧化物,所以氢氧化铝可溶解在氨水中 |
| C、浓硝酸易分解,所以要用棕色瓶盛放,且放在阴凉处保存 |
| D、金刚石是自然界中硬度最大的物质,所以金刚石不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
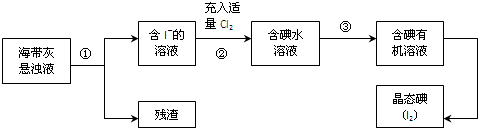
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(CH4):V(O2)=3:1 |
| B、m(CH4):m(O2)=3:2 |
| C、n(CH4):n(O2)=3:2 |
| D、M(CH4):M(O2)=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g N2中含有氮原子数为nA |
| B、1molNa与足量O2反应转移的电子数为nA |
| C、常温常压下,22.4LCO2中含有的分子数为nA |
| D、1mol?L-1K2SO4溶液中含有的钾离子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化钠与水反应:Na2O+H2O═2Na++2OH- |
| B、稀硫酸与氧化铁反应:Fe2O3+6H+═2Fe3++3H2O |
| C、食盐水中滴加硝酸银溶液:Cl-+Ag+═AgCl↓ |
| D、氢氧化钡溶液跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4?5H2O属于纯净物 |
| B、凡能电离出H+的化合物均属于酸 |
| C、纯碱、烧碱、碱石灰均属于碱 |
| D、盐类物质一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
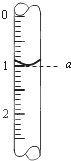 滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.
滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com