
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、元素原子的最外层电子数等于该元素的最高化合价 |
| C、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| D、VIIA族元素阴离子的还原性越强,元素最高价氧化物对应水化物的酸性也越强 |


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂属于酯类 |
| B、天然油脂大多为单甘油酯 |
| C、油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| D、油脂在常温下的存在状态主要决定于分子中碳原子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量浓盐酸 |
| B、加入几滴氯化铜溶液 |
| C、加入少量铁粉 |
| D、加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别中和等质量的氢氧化钠,消耗盐酸和醋酸溶液的体积相同 |
| B、分别跟足量的镁完全反应,无法比较两者产生氢气的总量大小 |
| C、滴入2滴甲基橙试液后加入等体积的pH=12的Ba(OH)2,溶液仍呈红色 |
| D、分别加水稀释相同的倍数,盐酸中由水电离出的c(H+)比醋酸溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应活化能小于100kJ?mol-1 |
| B、逆反应活化能一定小于100kJ?mol-1 |
| C、逆反应活化能大于正反应活化能 |
| D、正反应活化能不小于100kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用丁达尔现象可以区分乙醇溶液和淀粉溶液 |
| B、16O转化为18O属于化学变化 |
| C、实验室中,钠通常保存在盛有煤油的细口瓶中 |
| D、定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
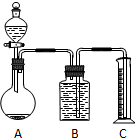 甲.乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲.乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com