
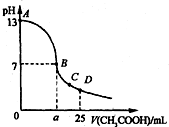
 25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )
25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )| A. | C点时c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | B点的横坐标a>12.5 mL |
分析 在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+);曲线上A、B间的点上,当醋酸较少时,会满足:c(OH-)>c(CH3COO-);结合电荷守恒及溶液的pH进行解答.
解答 解:A.在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)<c(CH3COO-),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,c(Na+)=0..05mol/L,c(CH3COO-)+c(CH3COOH)=2c(Na+),故B正确;
C.在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,当醋酸少量时,可能会出现c(OH-)>c(CH3COO-),故C错误;
D.在B点溶液显中性,则c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,当恰好完全反应时,所需醋酸的体积为12.5mL,则B点a>12.5 mL,故D正确;
故选C.
点评 本题考查了溶液酸碱性的定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱性溶液溶液pH的关系,明确溶液pH的表达式及计算方法,C为易错点,注意A、B间任一点,当醋酸少量时,会出现c(OH-)>c(CH3COO-).


科目:高中化学 来源: 题型:填空题
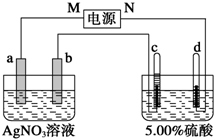 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水与乙醇的混合物 | |
| B. | 用激光笔检验淀粉溶液的丁达尔现象 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 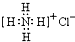 :可以表示氯化铵的电子式 :可以表示氯化铵的电子式 | |
| B. |  :可以表示中子数为18的氯原子结构示意图 :可以表示中子数为18的氯原子结构示意图 | |
| C. | 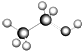 :可以表示乙醇分子的球棍模型 :可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
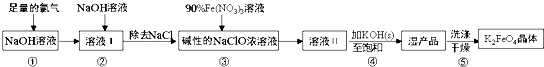
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
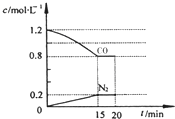 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com